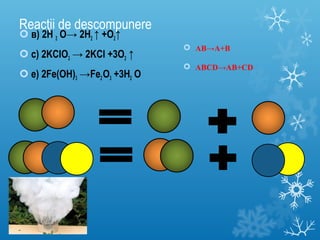
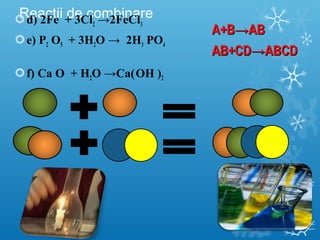
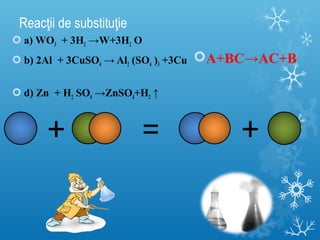
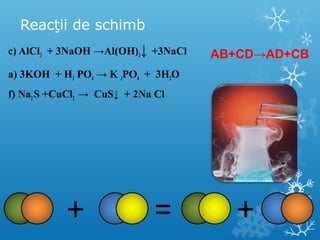
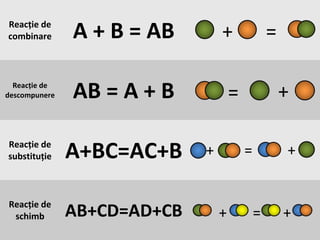
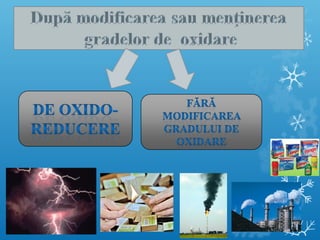
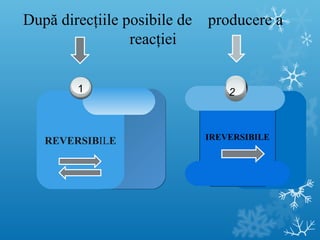
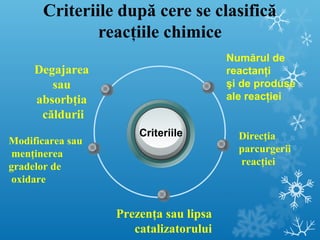
Documentul se concentrează pe reacțiile chimice, clasificarea acestora în funcție de diverse criterii, cum ar fi efectul termic și prezența catalizatorilor. Sunt prezentate exemple de reacții de combinare, descompunere și substituție, precum și ecuații chimice corespunzătoare. Întrebări și teste sunt incluse pentru a evalua înțelegerea conceptelor discutate.