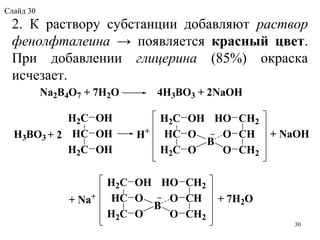
Документ представляет лекцию по фармацевтической химии, охватывающую лекарственные вещества, их производные и фармакопейные источники. Включены подробные описания свойств, применения и методов анализа неорганических и органических веществ, таких как активированный уголь и натрия гидрокарбонат. Лекция также предоставляет информацию об идентификации, количественном анализе и хранении этих веществ.













![3. Реакция (а) на натрий
а) + калия карбонат → и нагревают до кипения; осадок не
образуется → добавляют раствор калия пироантимоната
и нагревают до кипения, затем охлаждают в ледяной воде и,
если необходимо, потирают внутренние стенки пробирки
стеклянной палочкой; образуется густой осадок белого
цвета.
NaHCO3 + K[Sb(OH)6]
Na[Sb(OH)6]↓ + KHCO3
14
Слайд 14](https://image.slidesharecdn.com/3-4-150622061548-lva1-app6892/85/3-4-14-320.jpg)















![3. реакции на натрий:
а) с раствором калия пироантимоната (калия
гексагидроксостибиата (V)) - образуется белый осадок:
Na2B4O7 + K[Sb(OH)6] → ↓Na[Sb(OH)6] + K2B4O7
b) с раствором реактива метоксифенилуксусной
кислоты - образуется объемный белый
кристаллический осадок:
с) соль натрия, смоченная кислотой
хлористоводородной разведенной и внесена в
бесцветное пламя, окрашивает его в желтый цвет.
Na2B4O7 + C6H5 C
H
COO-
[N+
(CH3)4]
OCH3
C6H5 C
H
COONa↓ + [N(CH3)4]2B4O7
OCH3
31
Слайд 31](https://image.slidesharecdn.com/3-4-150622061548-lva1-app6892/85/3-4-31-320.jpg)









![ИДЕНТИФИКАЦИЯ
1. Субстанция дает характерные реакции на алюминий.
К раствору субстанции добавляют HCl разведенную и
тиоацетамидный реактив → осадок не образуется.
Al3+
+ 3NaOH → Al(OH)3↓ + 3Na+
Al(OH)3↓ + 3NaOH → Na3[Al(OH)6]
Na3[Al(OH)6] + 3NH4Cl → Al(OH)3↓ + 3NaCl + 3NH4OH
Далее + каплями раствор NaOH
разведенный → образуется гелеобразный
белый осадок, который растворяется при
последующем добавлении раствора NaOH
разведенного. К полученному раствору
постепенно добавляют раствор NH4OH
→ снова образуется гелеобразный
белый осадок.
41
Слайд 41](https://image.slidesharecdn.com/3-4-150622061548-lva1-app6892/85/3-4-41-320.jpg)







