Thực hành hóa đại cương
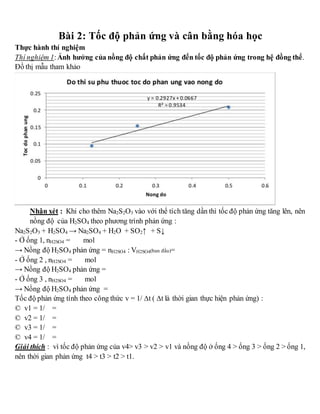
- 1. Bài 2: Tốc độ phản ứng và cân bằng hóa học Thực hành thí nghiệm Thí nghiệm 1:Ảnh hưởng của nồng độ chất phản ứng đến tốc độ phản ứng trong hệ đồng thể. Đồ thị mẫu tham khảo Nhận xét : Khi cho thêm Na2S2O3 vào với thể tích tăng dần thì tốc độ phản ứng tăng lên, nên nồng độ của H2SO4 theo phương trình phản ứng : Na2S2O3 + H2SO4 → Na2SO4 + H2O + SO2↑ + S↓ - Ở ống 1, nH2SO4 = mol → Nồng độ H2SO4 phản ứng = nH2SO4 : VH2SO4(ban đầu)= - Ở ống 2 , nH2SO4 = mol → Nồng độ H2SO4 phản ứng = - Ở ống 3 , nH2SO4 = mol → Nồng độ H2SO4 phản ứng = Tốc độ phản ứng tính theo công thức v = 1/ ∆t ( ∆t là thời gian thực hiện phản ứng) : © v1 = 1/ = © v2 = 1/ = © v3 = 1/ = © v4 = 1/ = Giải thích : vì tốc độ phản ứng của v4> v3 > v2 > v1 và nồng độ ở ống 4 > ống 3 > ống 2 > ống 1, nên thời gian phản ứng t4 > t3 > t2 > t1.
- 2. Điều kiện để phản ứng là phải tiếp xúc và va chạm vào nhau. Tần số va chạm càng lớn thì phản ứng xảy ra càng nhanh, tức là khi ta tăng nồng độ thì mật độ các chất tăng lên, khả năng va chạm giữa các tăng nên phản ứng xảy ra nhanh hơn Thời gian: Ống 1: 15s06 Ống 2: 33s58 Ống 3: 56s Ống 4:1p18s Thí nghiệm 2 : Ảnh hưởng của nhiệt độ đến tốc độ phản ứng. Đồ thị mẫu tham khảo Nhận xét : Thời gian phản ứng xảy ra càng nhanh khi phản ứng xảy ra ở nhiệt độ càng cao . Giải thích hiện tượng : 5H2C2O4 + 2KMnO4 + 3H2SO4 → 10CO2 + 2MnSO4 + K2SO4 + 8H2O Khi nhiệt độ phản ứng tăng thì: - Tốc độ chuyển động của các phân tử tăng tần số va chạm giữa các chất phản ứng tăng. - Tần số va chạm có hiệu quả giữa các chất phản ứng tăng nhanh. Tốc độ phản ứng tăng. Theo phương trình hóa học, khi tăng nhiệt độ lên, phản ứng hóa học quá trình trao đổichất nhanh hơn. Mà tốc độ phản ứng tỉ lệ nghịch với nhiệt độ phản ứng theo công thức v = 1/ ∆t, nhiệt độ càng tăng thì tốc độ phản ứng sẽ tăng theo. Thời gian: Ống 1: 0oC và 2p49s Ống 2: Nhiệt độ phòng 250C và 1p2s Ống 3: 40.90C và 36s Thí nghiệm 3 : Ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng.
- 3. So sánh hiện tượng xảy ra - Ở hai ông nghiệm đá vôi đều tan dần trong dung dịch HCl tạo thành dung dịch trong suốt và giải thoát bọtkhí - Ống nghiệm đựng mẫu đá vôi đập nhỏ thì phản ứng xảy ra nhanh chóng hơn so với mẫu kia. - Phương trình phản ứng: CaCO3+ 2HCl -> CaCl2 + CO2 + H2O - Ống có cặn đen là tạp chất trong đá vôi Nhận xét: - Khi tăng diện tích tiếp xúc, tốc độ phản ứng tăng - Diện tích tiếp xúc tỷ lệ nghịch với kích thước của chất rắn. Giải thích: Khi tăng diện tíchtiếp xúc, bề mặt của các phần tử phản ứng sẽ tiếp xúc nhiều hơn, sự tiếp xúc giữa các tiểu phân phản ứng tăng, khiến tốc độ phản ứng tăng. Thời gian: Đá vôi đập nhỏ 3p26s , Mẩu đá vôi:10p38s Trả lời câu hỏi 1. Trong các lần thí nghiệm tiến hành ở thí nghiệm 1,2 tổng thể tích của các dung dịch phản ứng phải cố định để biết chính xác được các yếu tố ảnh hưởng đến tốc độ phản ứng như nhiệt độ, chất xúc tác, nhiệt độ ở cùng thể tích nhất định. 2. Tốc độ phản ứng bằng nghịch đảo của khoảng thời gian phản ứng vì - v = 1/ ∆t đúng là tốc độ của phản ứng đang khảo sát, vì trước đó ta có công thức : v = ∆C / ∆t , thời gian tỉ lệ nghịch với tốc độ phản ứng nên tốc độ phản ứng càng lớn thì thời gian xảy ra càng bé. - Quan niệm như trên sẽ không ảnh hưởng đến tốc độ phản ứng.
- 4. Bài 3: Tốc độ phản ứng và cân bằng hóa học (tt) Thí nghiệm 1 : Ảnh hưởng của chất xúc tác đến tốc độ phản ứng Chất xúc tác đồng thể: * Nhận xét : Phản ứng có chất xúc tác thì xảy ra nhanh hơn so với phản ứng không có chất xúc tác. Giải thích hiện tượng : xúc tác có thể hay đổi hình dạng: từ dạng hạt sang dạng bụi nhỏ. Xúc tác có tính chọn lọc, hướng quá trình đi vào phản ứng chính, giảm tốc độ phản ứng phụ, làm tăng hiệu suất sản phẩm chính, tốc độ phản ứng nhanh khi cho thêm chất xúc tác vào. Chất xúc tác dị thể: Hiện tượng: Ở điều kiện thường H2O2 phân hủy rất chậm tạo ra các bọt khí Lúc cho thêm MnO2 vào, sự phân hủy diễn ra nhanh hơn, các bọt khí thoát ra liên tục và nhiều hơn so với ống không có xúc tác Khi cho tàn đóm vào miệng hai ống nghiệm, que đóm đều bùng cháy nhưng với ống nghiệm có xúc tác ngọn lửa lại bùng cháy mãnh liệt hơn hẳn. Giải thích: Ở cá hai ống nghiệm đều xảy ra phản ứng phân hủy H2O2 theo phương trình 2H2O2 -> 2H2O + O2 Chính khí oxi thoát ra đã làm que đóm bùng cháy lên. Đối với ống nghiệm có chất xúc tác, tốc độ phản ứng tăng khiến cho lượng khí oxi thoát ra nhiều hơn nên làm cháy que đóm bùng cháy hơn. Thí nghiệm 2 : Ảnh hưởng của nồng độ chất phản ứng trong hệ đồng thể đến cân bằng hóa học Hiện tượng: Xuất hiện phức màu đỏ máu So sánh màu ống nghiệm: Ống 1: Đỏ ban đầu, Ống 2: Đỏ đậm, Ống 3: Đỏ, Ống 4: Vàng cam Ống 2 và Ống 3 có màu đỏ đậm hơn hơn ống 1 (Ống chuẩn). Màu ống 2 nhạt hơn ống 3. Ống 4 có màu nhạt hơn ống 1 Giải thích: Mọi sự chuyển dịch cân bằng đều tuân theo nguyên lý Le Chatelier Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi tăng nồng độ một chất thì cân bằng sẽ chuyển dịch theo hướng làm giảm nồng độ chất đó và ngược lại.
- 5. Ống 2: Khi thêm NH4SCN sẽ làm tăng nồng độ NH4SCN, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ NH4SCN là chiều thuận, tạo ra nhiều sản phẩm có phức màu đỏ máu nên khiến ống nghiệm có màu đỏ đậm hơn so với ống 1. Tương tự ống 3 Ống 4: Khi thêm NH4Cl sẽ làm tăng nồng độ NH4Cl , cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ NH4Cl là chiều nghịch, làm giảm sản phẩm có phức màu đỏ máu sinh ra sản phẩm là muối sắt III có màu nâu vàng đặc trưng nên khiến ống nghiệm có màu đỏ nhạt hơn so với ống 1. Ống 2 có màu nhạt hơn ống 3 là vì Vì vậy khi tăng nồng độ FeCl3, lượng sản phẩm tăng lên 1 lần trong khi tăng nồng độ NH4SCN, lượng sản phẩm tăng gấp 1/3 lần theo tỷ lệ mol nFeCl3:nNH4SCN = 1:3 Thí nghiệm 3 : Ảnh hưởng của nhiệt độ đến cân bằng hóa học Hiện tượng: Lấy ống 1 làm chuẩn Ống 2: Màu nâu đỏ của khí trong ống nghiệm nhạt dần và trở thành không màu Ống 3: Màu đỏ đậm so với ống 1 Giải thích: Ống 2: Cân bằng chuyển dịch theo chiều thuận (Chiều tỏa nhiệt) tạo ra N2O4 nên khiến màu khí trong ống nhạt hơn Ống 3: Cân bằng chuyển dịch theo chiều nghịch (Chiều thu nhiệt) tạo ra nhiều lượng khí NO2 khiến cho khí trong ống nghiệm có màu đậm hơn so với ống 1. Theo nguyên lý chuyển dịch cân bằng của Le Chatelier Khi tăng nhiệt độ của hệ thì cân bằng chuyển dịch về phía làm giảm nhiệt độ, nghĩa là cân bằng chuyển dịch về phía thu nhiệt. Khi giảm nhiệt độ, cân bằng chuyển dịch về phía làm tăng nhiệt độ, nghĩa là cân bằng chuyển dịch về phía tỏa nhiệt. Trả lời câu hỏi 1. - Chẻ nhỏ củi, đập nhỏ than để đốtđể lửa bén tốt hơn do tăng diện tích tiếp xúc giữa than với oxi - Bò bóp thấu phải cắt lát mỏng rồi trộn chanh giúp thấm nhanh ăn thêm ngon - 2. 2KMnO4+ 5H2C2O4+3H2SO4 -----> 2MnSO4 + 8H2O +10 CO2 +K2SO4 Vì 8H(+) + 5e + MnO4(-) ----> Mn(2+) + 4H2O C2O4(2-) ------> 2CO2 + 2e _____________________________________
- 6. 16H(+) + 2MnO4(-) + 5C2O4(2-) -----> 2Mn(2+) + 8H2O +10 CO2 Khi thêm Mn2+, có phản ứng sau: MnO4- + Mn2+ + H+ --> Mn3+ + H20. Thuyết năng lượng hoạt hóa Ion Mn3+ có tính oxy hóa mạnh và trái dấu với ion oxalate nên phản ứng giữa hai ion này nhanh hơn. Do 2 ion chất khử và oxi hóa ban đầu đều mang dấu âm nên phản ứng xảy ra khó (năng lượng hoạt hóa cao). Tiến hành cho xúc tác vào thì xảy ra 2 phản ứng trung gian trên với 2 mốc năng lượng hoạt hóa giảm thấp hơn nhiều so với Ea ban đầu.(đều là va chạm giữa các ion trái dấu) Do đó phản ứng có Ea mới thấp hơn Ea ban đầu ==> xảy ra nhanh hơn 3. Trong thí nghiệm 2, phải thêm 2ml nước cât vào ống nghiệm 1 vì khi thực hiện thí nghiệm, các ông khác đều được thêm 2ml chất khác => Tạo sự đồng đều về mặt thể tích nhằm mục tiêu so sánh màu sắc giữa các ống một cách chính xác nhất. Nếu thể tích không bằng nhau việc so sánh dễ dẫn đến sai lệch kết quả (Dung dịch càng loãng màu càng nhạt và ngược lại). 4. Khi tăng nhiệt độ của hệ thì cân bằng chuyển dịch về phía làm giảm nhiệt độ, nghĩa là cân bằng chuyển dịch về phíathu nhiệt. (hấp thụ năng lượng dưới dạng nhiệt.) Khi giảm nhiệt độ, cân bằng chuyển dịch về phía làm tăng nhiệt độ, nghĩa là cân bằng chuyển dịch về phía tỏa nhiệt.(có sự giải phóng nănglượng dưới dạng nhiệt) Bài 4: Dung dịch chất điện ly Thí nghiệm 1 : Khảo sát khả năng dẫn điện của các chất Dung dịch các chất dẫn được điện: HCl, NaCl, NaOH, CH3COOH. Chất có khả năng dẫn điện thấp: NaCl tinh thể - Dung dịch: Saccarozo, C2H5OH, Glyxerol, nước cất Trong các dung dịch muối, bazơ hay axit khác đều có những ion dương và ion âm di chuyển tự do. Vì vậy dung dịch chất diện li dẫn được điện. Các chất như Saccarozo, C2H5OH, Glyxerol không có sự phân ly ra ion, không có ion tan trong nước nên cường độ dòng điện chạy qua thấp
- 7. Liên kết hoá học trong phân tử NaCl là liên kết ion. Trong tinh thể muối ăn, các ion Na+ ion Clˉ hút giữ nhau bằng lực hút tĩnh điện nên không thể di chuyển tự do được. Vì vậy tinh thể muối ăn không dẫn điện. Phương trình điện ly: HCl -> H+ + Clˉ NaOH ->Na+ + OHˉ NaCl -> Na+ + Clˉ CH3COOH CH3COO- + H+ -> Khả năng dẫn điện yếu H2O H+ + OH- Bằng máy đo thật nhạy người ta đã chứng minh được rằng, nước nguyên chất cũng dẫn điện. Nước điện li một phần rất nhỏ. Đã xác định được là, cứ 10 tỉ phân tử H2O thì có 18 phân tử điện li. Nước là một chất điện li yếu. Thí nghiệm 2:Xác định màu của chất chỉ thị màu Chất chỉ thị màu Axit Bazơ Trung tính Phenolphtalein Không màu Hồng Không màu Metyl dam cam Đỏ rượu vang Da cam Da cam Giải thích kết quả : màu của metylcam có màu vàng cam là màu của anion. Khi kết hợp với axit H2SO4 thì anion này kết hợp với protonH+ chuyển sang màu đỏ. Trong môi trường kiềm trước hết phenolphtalein thủy phân tạo ra axit, đồng thời do sự oxi hóa và sự tách nước tạo ra anion mang điện tích âm hai có cấu tạo quinoit nên dung dịch chuyển sang màu hồng. Vì nước cất không có sự phân ly ra ion như H+ , OH- để các chỉ thị đổimàu Thí nghiệm 3:Cân bằng trong dung dịch axit yếu và bazơ yếu a. Trong axit yếu - Ống 1 : khi cho thêm 1- 2 giọt metylcam thì phản ứng chuyển sang màu đỏ nhạt. Tiếp theo lắc đều thì không có hiện tượng gì xảy ra nữa. - Ống 2 : khi cho thêm 1-2 giọt metylcam thì phản ứng cũng có màu đỏ nhạt. Tiếp theo cho thêm natri axetat và lắc đều phản ứng từ màu hồng chuyển sang màu da cam. Giải thích thí nghiệm :
- 8. Từ thí nghiệm ta đã biết, khi thêm 1-2 giọt metylcam thì dung dịch CH3COOH chuyển sang màu hồng. Ống nghiệm 1 không cho thêm dung dịch nào vào,chất đã bão hòa không kết hợp với H+ mà tăng thêm màu. Ở ống nghiệm 2 khi cho thêm CH3COONa, mà CH3COONa là chất có axit yếu và bazơ mạnh, nên khi thêm CH3COONa vào thì bazơ mạnh sẽ tham gia phản ứng với dung dịch có màu đỏ nhạt và phản ứng chuyển sang màu cam. Kết luận về sự chuyển dịch : bazơ mạnh đẩy axit yếu ra khỏi dung dịch và tham gia vào qua trình phản ứng. b. Trong bazơ yếu Kết quả thí nghiệm : - Ống 1 : theo cách tiến hành thí nghiệm thì dung dịch có màu hồng đậm. - Ống 2 : dung dịch có màu hồng đậm và sau khi cho thêm vài tinh thể amoni clorua và lắc đều thì dung dịch chuyển sang không màu. Giải thích thí nghiệm : Khi cho thêm phenolphtalein vào NH3 thì phenolphtalein thủy phân tạo ra axit, đồng thời do sự oxi hóa và sự tách nước tạo ra anion mang điện tích âm hai có cấu tạo quinoit nên dung dịch chuyển sang màu hồng. Ở ống nghiệm 1 không có sự xúc tác của chất nào nên dung dịch chỉ dừng lại ở việc đổimàu, cònở ống nghiệm 2 có sự xúc tác của NH4Cl có gốc NH4 - là axit mạnh nên đẩy và phản ứng, và bị trung hòa nên không còn khả năng tạo quinoit, nên anion mang 3 điện tíchâm của muối phenolat không có màu. Trả lời câu hỏi 1. Khoảng đổimàu: Phenolphtalein: PH từ 8-10. Màu dạng bazơ: Hồng Metyl da cam: 3,1 – 4,4 Màu dạng axit: Đỏ, màu dạng bazơ: Vàng Cam 2. Phương trình: CH3COOH CH3COO- + H+ Ban đầu 0,001 Phản ứng x x x Cân bằng 0,001-x x x Độ điện ly Alpha = √ 10−4,75 0,001 = Ka= [ 𝐶𝐻3𝐶𝑂𝑂−].[𝐻+] [𝐶𝐻3𝐶𝑂𝑂𝐻] = 𝑥2 0,001−𝑥 = 10−4,75 x= [H+]= pH= -log[H+]=-log()=
- 9. Bài 5: Khảo sát tính chất của phi kim và hợp chất Thí nghiệm 1:Khảo sáttính chất của NH3 và NH4+ a. Hiện tượng quan sát được: - Nước trong chậu bị hút vào bình qua ống thủy tinh vuốt nhọn phun thành các tia nước có màu hồng Giải thích: Do khí NH3 tan rất nhiều trong nước. Ở 20oC, 1 lít NH3 có thể tan trong 800 lít nước. Do tan nhiều trong nước, áp suất của khí NH3 trong bình giảm đột ngột => Nước trong cốc bịhút vào. Nước có màu hồng vì dung dịch NH3 có tính bazơ nên bị phenolphtalein hóa hồng: NH3 + H2O NH4+ + OH- b. Hiện tượng: - Có khí mùi khai thoát ra - Quỳ tím ẩm chuyển sang màu xanh Giải thích: Khí mùi khai thoát ra là khí NH3 Ion NH4+ nhường H+ cho OH- tạo thành NH3 và H2O => Trong dung dịch ion NH4+ là một axit. Quỳ tím ẩm hóa xanh ra do NH3 tác dụng với nước trong quỳ tạo thành chất có tính bazơ theo phương trình: NH3 + H2O NH4+ + OH- Phương trình: NH4NO3 + NaOH -> NaNO3 + NH3 + H2O Phản ứng này dùng để nhận biết ion NH4+ c. Khả năng tạo phức Hiện tượng: Khi bắt đầu nhỏ NH3 vào, ống nghiệm đựng CuSO4xuất hiện kết tủa màu xanh lam, sau đó nhỏ thêm dung dịch NH3 thì kết tủa tan dần tạo thành dung dịch màu xanh lam đồng nhất. Đối với ống nghiệm đựng Al(NO3)3, khi bắt nhỏ NH3 vào sẽ xuất hiện kết tủa trắng keo, kết tủa này không tan khi nhỏ thêm dung dịch NH3. Giải thích: Phương trình: Cu2+ + 2NH3 + 2H2O -> Cu(OH)2 + 2NH4+ Cu(OH)2 + 4NH3 -> [Cu(NH3)4](OH)2 Cu(OH)2 + 4NH3 -> [Cu(NH3)4]2+ + 2OH- Al3+ + 3NH3 + 3H2O -> Al(OH)3 + 3NH4+ Do phân tử amoniac kết hợp với ion Cu2+ bằng các liên kết cho nhận giữa cặp electron chưa sử dụng của nguyên tử Nitơ với obitan trống của của ion Cu2+ (Các Ion kim loại
- 10. chuyển tiếp có phụ tầng d còn trống ...). Đối với Al3+, vì không có phụ tầng obitan trống nên không có khả năng tạo phức. Có thể dùng tính chất này phân biệt Zn2+ và Al3+. Thí nghiệm 2:Tính chấtcủa HNO3 và NO3- a. Tính chất của HNO3 Hiện tượng: - Ở ống nghiệm 1, có bọtkhí không màu thoát ra, khí này nhanh chóng hóa nâu trong không khí. - Ở ống nghiệm 2, có khí màu nâu đỏ thoát ra - Cu tan dần trong hai ống nghiệm tạo thành dung dịch màu xanh lam. Phương trình: Ống 1: 3Cu + 8HNO3 -> 3Cu(NO3)2 +2NO + H2O NO + ½ O2 -> NO2 Ống 2: Cu + 4HNO3 -> Cu(NO3)2 + 2NO2 + H2O “Ba đồng tám loãng hai no, một đồng 4 đặc thì cho khí màu” b. Nhận biết NO3- Hiện tượng: Cu tan dần trong ống nghiệm tạo thành dung dịch màu xanh lam. Có bọt khí không màu thoát ra, khí này nhanh chóng hóa nâu trong không khí. Phương trình: 3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O Trong môi trường trung tính ion NO3- không có tính oxi hóa tuy nhiên trong môi trường có H+, ion NO3- thể hiện tính oxi hóa như ở trong HNO3 Thí nghiệm 3:Khảo sáttính chất của H2SO4 Axit H2SO4 loãng: + Ống 1: Kết tủa xanh lam tan dần tạo thành dung dịch xanh thẫm + Ống 2: Bột CuO màu đen tan dần tạo thành dung dịch màu xanh + Ống 3: Mẫu đá vôi tan dần tạo thành dung dịch trong suốt, có bọt khí thoát ra + Ống 4: Viên kẽm tan dần tạo thành dung dịch trong suốt, có bọt khí thoát ra + Ống 5: Mảnh đồng không tan trong axit. Giải thích: + Ống 1: Kết tủa xanh lam là Cu(OH)2 tan dần tạo thành dung dịch CuSO4 theo phương trình: Cu(OH)2 + H2SO4 -> CuSO4+ H2O + Ống 2: Bột CuO tác dụng H2SO4 theo phương trình: CuO + H2SO4 -> CuSO4 + H2O Màu xanh lam của dung dịch là màu đặc trưng của ion Cu2+ + Ống 3: Bọt khí thoát ra là khí Cacbondioxit. Đá vôi tan theo phương trình
- 11. Phương trình: CaCO3 + H2SO4 -> CuSO4 + CO2 + H2O + Ống 4: Bọt khí thoát ra là khí hidro. Kẽm tan theo phương trình Zn + H2SO4 -> ZnSO4 + H2O + Ống 5: Đồng không tác dụng H2SO4 loãng Axit H2SO4 đặc: a.Vớiđường: Những viên đường hạt nhanh chóng bị hóa tạo thành muội than có màu đen. Axit H2SO4 đặc có tính háo nước mạnh nên đã hút hết nước trong phân tử đường Saccarozo tạo thành than theo phương trình H2SO4 đặc C12H22O11 -----------> 12C + 11H2O b.Vớiđồng Cu tan dần trong ống nghiệm tạo thành dung dịch màu xanh lam. Có khí không màu mùi hắc thoát ra 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối trong đó kim loại có hóa trị cao + H2O + SO2 (S, H2S). - Sản phẩm khử của S+6 tùy thuộc vào độ mạnh của kim loại: kim loại có tính khử càng mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp. Trong trường hợp này S+6 bị khử về mức S+4 (SO2) Trả lời câu hỏi 1. Khí NH3 tan rất nhiều trong nước. Ở 20oC, 1 lít NH3 có thể tan trong 800 lít nước. (Thí nghiệm 1) Trong phản ứng giữa ion NH4 + và OH- Ion NH4 + nhường H+ cho OH- tạo thành NH3 và H2O => Trong dung dịch ion NH4 + là một axit. 2. M + HNO3 → M(NO3)n + H2O + NO2 (NO, N2O, N2, NH4NO3) Sản phẩm khử của N+5 là tùy thuộc vào độ mạnh của kim loại và nồng độ của dung dịch axit. Thông thường thì dung dịch đặc → NO2, dung dịch loãng → NO; dung dịch axit càng loãng, kim loại càng mạnh thì N bị khử xuống mức càng sâu. 3. Sự linh hoạt và nồng độ của protonH+ phản ánh tính oxi hóa mạnh hay yếu của axit. Do cấu trúc của ion NO3- là phẳng, nên nguyên tử N trung tâm dễ dàng bị tấn công bởi các ion dương làm phá vỡ cấu trúc phẳng, nên NO3 - luôn có tính oxy hóa ở nồng độ đặc hay loãng vậy Còn H2SO4 chỉ khi ở nồng độ cao thì toàn phân tử H2SO4 mới có cấu trúc thuận lợi cho sự tấn công không gian, chính vì vậy nên chỉ với nồng độ đặc thì axit
- 12. sunfuric mới có tính oxy hóa, còn ở nồng độ loãng thì ion SO4 2- có cấu trúc tứ diện đều làm cho nguyên tử S trung tâm bị che chắn kỹ, không cho tác nhân bên ngoài tấn công vào. Ngoài ra số oxi hóa của S và N trong H2SO4 và HNO3 đều ở mức cao nhất nên có tính oxi hóa cao. 4. Cách nhận biết khí thoát ra: Khí thoát ra hóa nâu trong không khí NO + ½ O2 -> NO2 Bài 6: Khảo sát tính chất của kim loại và hợp chất Thí nghiệm 1:Tính chấtcủa Na và NaOH Hiện tượng: Na bốc cháy ngọn lửa màu xanh, phản ứng mãnh liệt với nước và giải phóng khí thoát ra. Dung dịch sau đó thu được làm quỳ tím hóa xanh và phenolphthalein hóa hồng. Giải thích: - Na có tính khử mạnh đã phản ứng với nước tạo thành khí Hidro thoát ra và dung dịch NaOH. - Dung dịch NaOH có tính kiềm nên làm quỳ tím hóa xanh và phenolphthalein hóa hồng. - Na + H2O -> NaOH + ½ H2 Thí nghiệm 2:Tính chấtcủa Al và Al3+ a. Al Hiện tượng: Khi cho Axit HCl vào, mẩu Al tan dần tạo thành dung dịch trong suốt và giải phóng bọt khí. Sau đó, nhỏ từ từ dd NaOH vào, thời gian đầu sẽ xuất hiện kết tủa trắng keo, tới một thời điểm kết tủa đạt cực đại, tiếp tục nhỏ dd NaOH dư vào thì kết tủa lại tan dần và tạo thành dd trong suốt lại. Giải thích: Ở thời điểm cho axit HCl vào, Al đã phản ứng với HCl để tạo thành dd muối AlCl3 trong suốt và giải phóng khí H2 theo pt: 2Al +6HCl -> 2AlCl3 + 3H2 Lúc cho NaOH vào kết tủa trắng keo tạo thành là Al(OH)3 3NaOH + AlCl3 -> Al(OH)3 + 3NaCl Tiếp tục cho dư NaOH, Al(OH)3 bị hòa tan tạo thành muối Natri Aluminat và nước Dung dịch trong suốt lại Al(OH)3 + NaOH -> NaAlO2 + 2H2O b. Al3+ Hiện tượng: Al tan dần trong dung dịch NaOH tạo dung dịch trong suốt và giải phóng khí thoát ra
- 13. Cho từ từ HCl vào, sau một thời gian sẽ xuất hiện kết tủa, kết tủa tăng dần đến mức cực đại, tiếp tục cho dư axit, kết tủa lại tan và tạo thành dung dịch trong suốt. Giải thích: Al phản ứng với NaOH và H2O để tạo thành dung dịch muối Aluminat và giải phóng khí H2. Trong phản ứng, Al đóng vai trò là chất khử và H2O là chất Oxi hóa. Al + NaOH + H2O -> NaAlO2 + 3/2 H2 Tiếp theo cho dd HCl vào, HCl sẽ phản ứng với NaOH dư trước nếu còn sau đó là NaAlO2 phản ứng với HCl và nước trong dung dịch để tạo thành kết tủa Al(OH)3 theo pt: NaOH + HCl -> NaCl + H2O NaAlO2 + H2O + HCl -> Al(OH)3 + NaCl Axit dư thì kết tủa lại bị hòa tan trở lại tạo thành dung dịch trong suốt là AlCl3 Al(OH)3 + 3HCl -> AlCl3 + 3H2O Thí nghiệm 3:Tính chấtcủa Fe, Fe2+ và Fe3+ a. Fe Hiện tượng: Một phần đinh sắt tan trong axit H2SO4, đồng thời có khí thoát ra từ ống nghiệm. Cho từ từ NaOH vào, có kết tủa trắng xanh xuất hiện, cho thêm NaOH dư, kết tủa đến cực đại và không tan. Để yên 5 phút, kết tủa bị hóa thành màu nâu đỏ. Giải thích: Ở thời điểm cho axit H2SO4 vào, Fe đã phản ứng với H2SO4 để tạo thành dd muối FeSO4 trong suốt có màu lục nhạt và giải phóng khí H2 theo pt: Fe + H2SO4 -> FeSO4 + H2 Lúc cho NaOH vào kết tủa trắng xanh tạo thành là Fe(OH)2 2NaOH + FeSO4-> Fe(OH)2 + Na2SO4 Sao một thời gian kết tủa trắng xanh Fe(OH)2 phản ứng với nước và oxi trong không khí để tạo thành kết tủa nâu đỏ Fe(OH)3 2Fe(OH)2 + ½ O2 + H2O -> 2Fe(OH)3 b. Fe2+ Hiện tượng: Màu tím của dung dịch KMnO4 bị mất đi, thay vào đó dung dịch có màu nâu đặc trưng của ion Fe3+ Giải thích: KMnO4 có tính oxi hóa mạnh còn Fe2+ có tinh khử, H2SO4 đóng vai trò môi trường. Do đó khi cho 2 dd tác dụng sẽ xảy ra phản ứng oxi hóa Fe2+ -->Fe3+ và khử Mn(+7) -> Mn(+2) do đó làm mất màu tím của KMnO4 (KMnO4 ->MnSO4). Fe3+ sinh ra làm dd có màu nâu nhạt. 2KMnO4 + 10FeSO4 + 8H2SO4 ------> 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
- 14. c. Fe3+ Hiện tượng: Màu vàng nâu của dung dịch sắt III clorua (FeCl3) đổi sang màu xanh nhạt và xuất hiện kết tủa đen tím. Cho thêm hồ tinh bột vào, xuất hiện phức chất màu xanh Giải thích: FeCl3 phản ứng với KI tạo thành dd màu xanh nhạt của dung dịch sắt II clorua (FeCl2) và xuất hiện kết tủa đen tím Iod (I2). Chính I2 là tác nhân làm xuất hiện phức chất màu xanh khi cho thêm hồ tinh bộtvào. FeCl3 + KI -> FeCl2 + ½ I2 + KCl Thí nghiệm 3:Tính chấtcủa Cu và Cu2+ a. Cu A1. Hiện tượng: Ống 1: Đồng không tác dụng H2SO4 loãng, quỳ tím ẩm giữ nguyên màu Ống 2: Cu tan dần trong ống nghiệm tạo thành dung dịch màu xanh lam. Có khí không màu mùi hắc thoát ra, quỳ tím ẩm hóa đỏ Giải thích: Ở ống 1, không xảy ra hiện tượng hóa học ống 2, dung dịch xanh lam tạo ra là CuSO4, khí thoát ra là khí SO2 là một oxit axit, khi gặp nước trong quỳ tím ẩm sẽ tạo thành H2SO3 làm quý ẩm hóa đỏ 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O A2. Hiện tượng: Dung dịch trong suốt không màu hóa xanh lam, đồng tan một phần và có xuất hiện bạc bám trên miếng đồng và ống nghiệm. Giải thích: AgNO3 không màu phản ứng với Cu tạo thành muối Cu(NO3)2 màu xanh lam và kết tủa Ag. AgNO3 + Cu -> Cu(NO3)2 + Ag b. Cu2+ Hiện tượng: Xuất hiện kết tủa xanh lam, NaOH dư kết tủa không tan Giải thích: Kết tủa xanh lam sinh ra do phản ứng giữa hai dd là Cu(OH)2 CuSO4 + 2NaOH -> Cu(OH)2 + Na2SO4 Thí nghiệm 5:Tính chấtcủa Cr3+ Hiện tượng: Ở nhiệt độ thường, dung dịch muối CrCl3 có màu tím đỏ, khi đun nóng thì chuyển sang màu lục. Giải thích: Muối CrCl3 tan hết sức chậm trong nước. Khi đun nóng, quá trính tan diễn ra nhanh hơn. Ion Cr3+ trong dung dịch tồn tại dưới dạng [ Cr(H2O) ]3+ có màu lục Phương trình: CrCl3 +3 NaOH -> Cr(OH)3 + 3NaCl
- 15. Cr(OH)3 + NaOH -> NaCrO2.2H2O (natri cromit) Cr(OH)3 + 3HCl -> CrCl3 + 3H2O BÀI 7: KHẢO SÁT TÍNH CHẤT CỦA HIDROCACBON, ANCOL, PHENOL Thí nghiệm 1:Khảo sáttính chất của Etylen a. Etylen tác dụng Brom Hiện tượng quan sát được:Trong ống đựng Etanol có xuất hiện các bọt khí. Khí thoát ra làm mất màu dung dịch Brom Pt: C2H5OH -> C2H4 + H2O CH2=CH2 + Br2 -> CH2Br-CH2Br Đây là phản ứng cộng electrophin b. Etylen tác dụng thuốc tím Hiện tượng quan sát được:Trong ống đựng Etanol có xuất hiện các bọt khí. Khí thoát ra làm mất màu dung dịch thuốc tím. Đồng thời có kết tủa đen xuất hiện 3C2H4 + 4H2O + 2KMnO4 → 2KOH + 2MnO2 + 3C2H4(OH)2 Đây là phản ứng cộng electrophin Thí nghiệm 2:Khảo sáttính chất của Axetylen a. Tác dụng Brom Hiện tượng: Khí thoát ra từ đất đèn làm mất màu dung dịch Brom CaC2 + 2H2O -> C2H2 + Ca(OH)2 Giải thích: Trong phân tử Axetylen có liên kết ba trong đó có 2 liên kết pi kém bền và một liên kết xichma bền => tác dụng với Brom làm mất màu dung dịch Quá trình cộng gồm hai bước: Br2 + C2H2 → C2H2Br2 C2H2Br2 + Br2 → C2H2Br4 Tóm lại:
- 16. 2Br2 + C2H2 → C2H2Br4 b. Tác dụng dung dịch AgNO3/OH- Khi cho AgNO3 tác dụng dd NH3: Hiện tượng quan sát được:Xuất hiện kết tủa màu vàng trong ống nghiệm sau đó ngả xám. Giải thích: Vì C2H2 tác dụng với AgNO3/NH3 cho kết tủa vàng nhạt là C2Ag2. Chất này rất dễ bị oxi hóa phân giải ra bạc nên ngả xám là màu của bạc. Phân hủy Bạc Axetylua có thể gây nổ Pt: Ag2C2 -> 2Ag + 2C Phản ứng cộng electrophin Thí nghiệm 3:Khảo sáttính chất của Hydrocacbonthơm 1. Phản ứng oxi hóa benzene và toluene bằng thuốc tím
- 17. HIỆN TƯỢNG:Ống nghiệm nhỏ benzen vào xảy ra hiện tượng dung dịch tách lớp, hai dung dịch không hòa tan vào nhau Ống nghiệm nhỏ Toluen vào thì dung dịch thuốc tím bị mất màu, xuất hiện kết tủa màu đen Pt: Đây là phản ứng thế Electrophin 9H2SO4 + 6KMnO4 + 5C6H5CH3 → 14H2O + 6MnSO4 + 3K2SO4 + 5C6H5COOH e 2. Phản ứng Nitro hóa Benzen Hiện tượng: Dung dịch thu được có màu vàng, mùi thuốc súng Phản ứng thuộc loại thế electrophin Thí nghiệm 4:Khảo sáttính chất ancol
- 18. 1. Tác dụng Na kim loại Hiện tượng: Mẫu Na bốc cháy, tác dụng với Etanol khan, dd thu được sau phản ứng làm quỳ hóa xanh Giải thích: C2H5OH + Na → C2H5ONa + 1/2H2 C2H5ONa + H2O → C2H5OH + NaOH NaOH làm quỳ hóa xanh 2. Phản ứng este hóa CH3COOH + CH3CH(CH3)CH2CH2OH <----> CH3COOCH2CH2CH(CH3)2 + H2O Thu được dung dịch trong suốt, có mùi dầu chuối 3. Thí nghiệm 3 3CH3CH2OH + 2K2Cr2O7 + 8H2SO4 --> 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O Dung dịch mất màu vàng cam (của K2Cr2O7), chuyển sang màu xanh lục (của Cr2(SO4)3). Phản ứng này dùng để đo nồng độ cồn 3CH3CH(OH)CH3 + K2Cr2O7 + 4H2SO4 = 3CH3COCH3 + Cr2(SO4)3 + K2SO4 + 7H2O