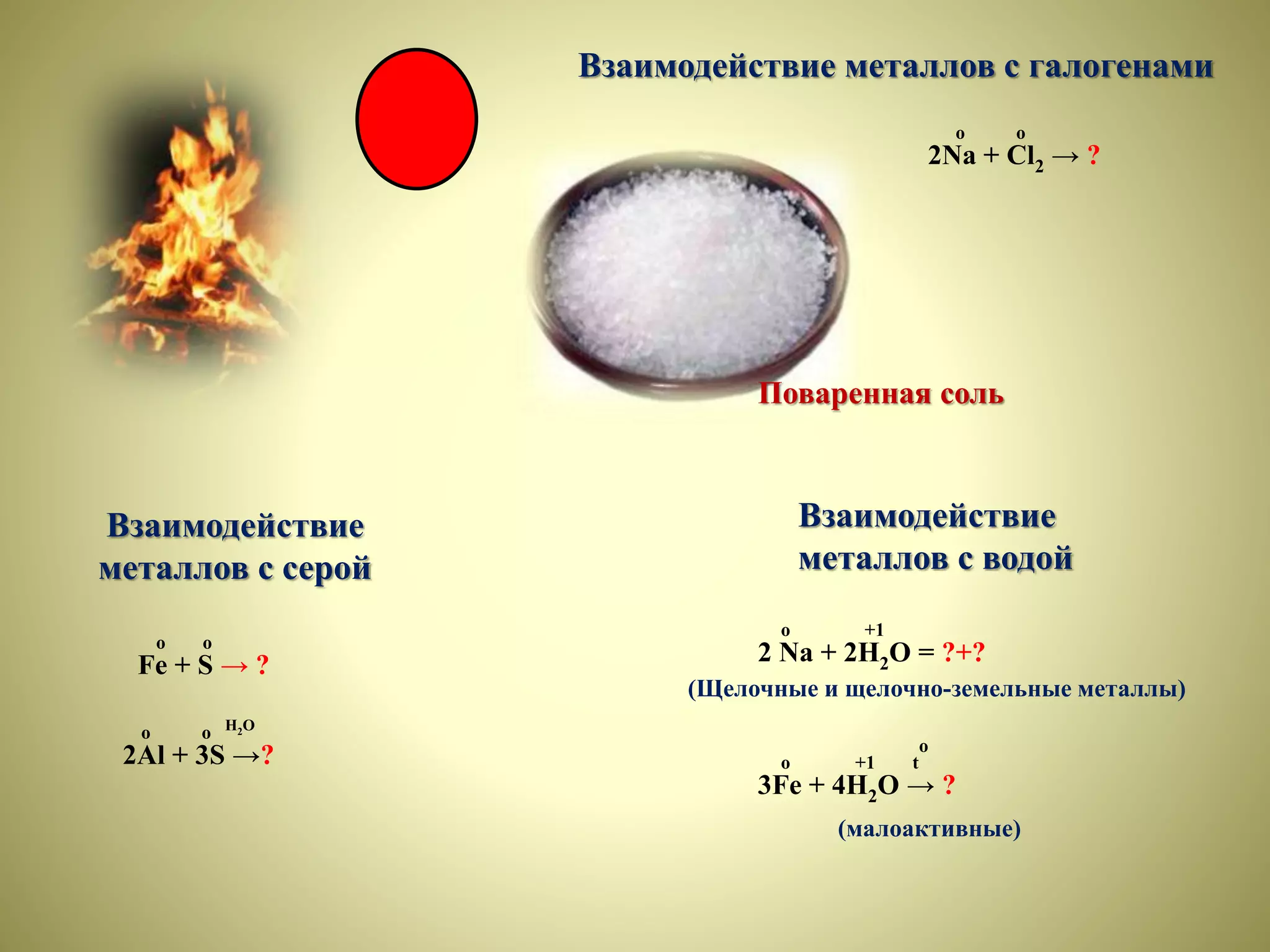
Документ описывает урок по химии для 9 класса, посвященный металлам, их свойствам, взаимодействиям и коррозии. Урок включает эксперименты, методы защиты от коррозии и обсуждение роли металлов в жизни человека, а также проблемы, связанные с их токсичностью. В конце урока предусмотрены задания на дом и рефлексия о полученных знаниях.