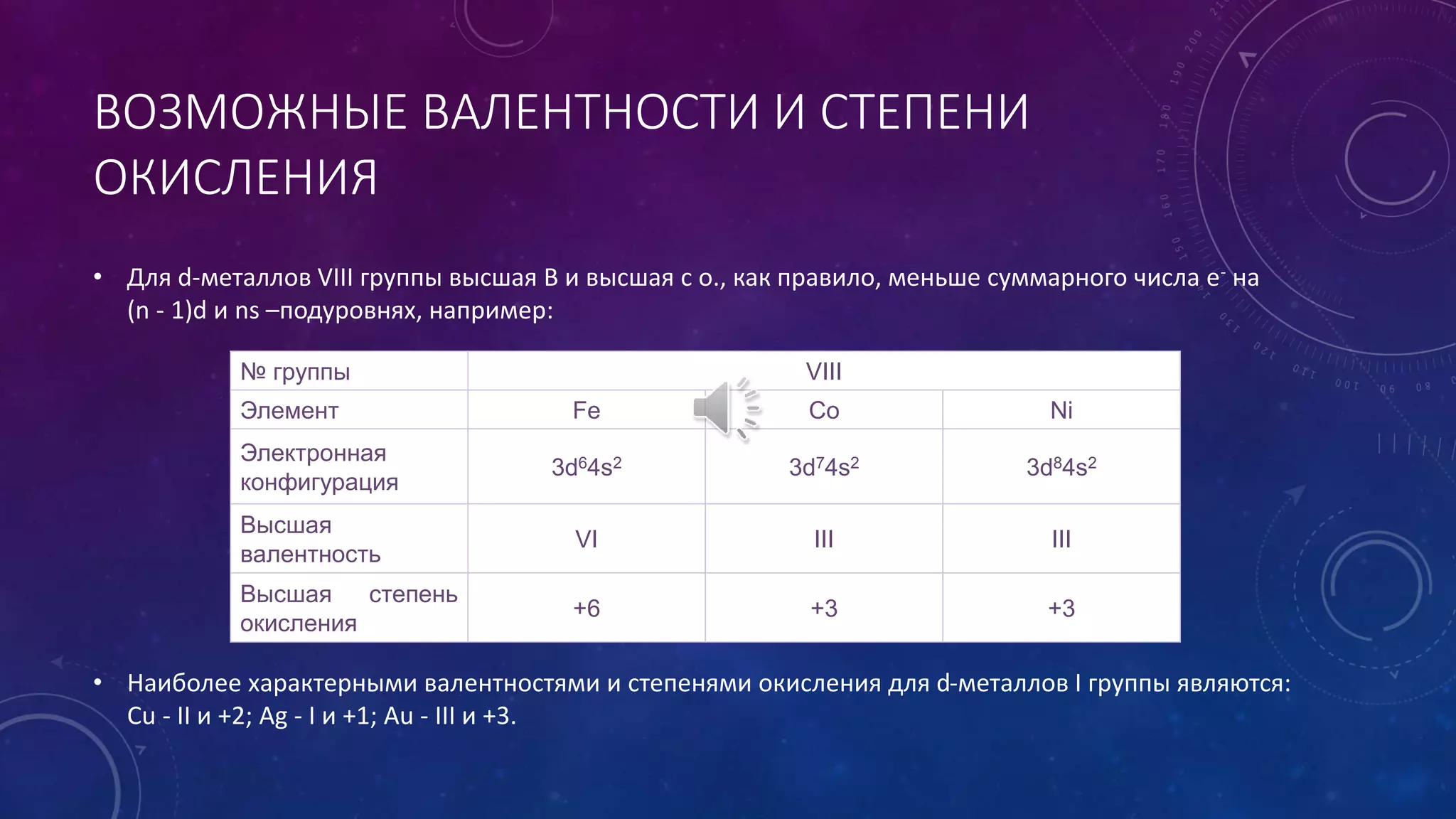
Документ описывает особенности металлов побочных подгрупп периодической таблицы, включая их переменную валентность и степень окисления, а также способность к комплексообразованию. Упоминаются физические и химические свойства, такие как восстановительная активность и изменяющийся характер оксидов и гидроксидов в зависимости от степени окисления. В документе также рассматривается применение и нахождение этих металлов в природе.






![• Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n - 1)d -, ns - и nр-подуровнях), что
позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных
электронных пар (молекулы NH3, Н2O, ионы ОН-, CN- и др.).
•
Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
•
[Cu(NH3)4]CI2, K3[Fe(CN)6],
•
Na2[Zn(OH)4), [Cr(H2O)6](NО3)3
•
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями. Восстановительная
активность различных d - металлов изменяется в широких пределах: среди них есть металлы средней активности,
находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.); малоактивные металлы (Сu, Нg и др.) и благородные
металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
• В водных растворах эти соединения подвергаются электролитической диссоциации:
СПОСОБНОСТЬ К КОМПЛЕКСООБРАЗОВАНИЮ](https://image.slidesharecdn.com/microsoftpowerpoint-160409140359/75/slide-8-2048.jpg)





