More Related Content
DOC
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี DOC
DOC
DOC
DOC
DOC
DOC
What's hot
PPT
อัตราการเกิดปฏิกิริยาเคมี PPTX
PDF
PDF
PDF
PDF
ข้อสอบเอ็นทรานซ์ เคมี มีนาคม 2546 PDF
PPT
PPT
PDF
PDF
PDF
PDF
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย PPT
PPTX
PDF
Viewers also liked
PPS
PPTX
PPTX
Building an Online Community PPTX
PDF
PIZ BUIN Consumer Brochure 2010 Czech PPTX
Similar to Som
DOC
PDF
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี PDF
PPT
PDF
PPT
DOC
DOC
โจทย์อัตราการเกิดปฏิกิริยาเคมี DOC
โจทย์อัตราการเกิดปฎิกิริยาเคมี PDF
DOC
PDF
Lab 2 acid base titration and applications PDF
DOC
DOC
อัตราการเกิดปฎิกิริยาเคมี DOC
ปัจจัยที่มีผลต่อการเกิดปฎิกริยาเคมี DOC
DOC
PDF
Som
- 1.
. ความเข้มข้นของสารกบอัตราการเกิดปฏิกิริยาเคมี
จากการศึกษาอัตราการสลายตัวของไดไนโตรเจนเพน
ตะออกไซด์ในช่วงเวลาต่างๆ พบว่าเมื่อเวลาผ่านไปอัตราการเกิด
ปฏิกิริยาเคมีมีค่าลดลงนักเรียนคิดว่าเป็นผลมาจากความเข้มข้น
ของสารตั้งต้นลดลงหรือไม่ เพื่อตรวจสอบว่าความเข้มข้นของ
สารมีผลต่ออัตราการเกิดปฏิกิริยาเคมีหรือไม่ ให้นักเรียนศึกษา
จากการทดลองต่อไปนี้
การทดลอง ความเข้มข้นของสารกับอัตราการเกิด
ปฏิกิริยาเคมี
ตอนที่ ١ ใช้สารละลายโซเดียมไทโอซัลเฟตที่มีความเข้มข้นต่าง
กันทำาปฏิกิริยากับสารละลายกรดไฮโดรคลอรอกที่มีความเข้มข้น
คงที่
1. รินสารละลายกรดไฮโดรคลอริก ٣ mol/dm3 จำานวน ١٠
cm3 ลงในหลอดทดลองขนาดใหญ่
2. นำากระดาษสีขาวทีทำาเครื่องหมายกากบาทไว้มาวางชิด
่
ข้างหลอดทดลองด้านหนึ่ง โดยให้เครื่องหมายกากบาทอยุ่
สูงจากก้นหลอดประมาณ ٢.٥ cm
3. เติมสารละลายโซเดียมไทโอซัลเฟต ٠.٣ mol/dm3
จำานวน ١٠ cm3 ลงในหลอดทดลองในข้อ ١ เขย่าให้เข้ากัน
สังเกตเครื่องหมายและจับเวลาตั้งแต่ผสมสารละลายเข้า
ด้วยกันนกระทั่งเริ่มมองไม่เห็นเครื่องหมายกากบาท
4. ทำาการทดลองอีก ٤ ครั้ง โดยใช้โซเดียมไทโอซัลเฟต
ผสมกับนำ้ากลั่นตามปริมาตรที่กำาหนดให้ในตาราง แต่ใช้
ปริมาตรของกรดไฮโดรคลอริกเท่าเดิม
ตารางกำาหนดปริมาตรของสารละลายโซเดียมไทโอ
ซัลเฟตและนำำาที่ใช้ในการทดลองตอนที่ ١
- 2.
หลอด ปริมาตรของสารละลาย ปริมาตรของนำำา
ที่ Na2S2O3 (cm3) (cm3)
١ ١٠ ٠
٢ ٨ ٢
٣ ٦ ٤
٤ ٤ ٦
٥ ٢ ٨
ตอนที่ ٢ ใช้สารละลายกรดไอโดรคลอริกที่มีความเข้มข้นต่าง
กันทำาปฏิกิริยากับสาระลายโซเดียมไทโดซัลเฟตที่มีความเข้ม
ข้นคงทีทำาการทดลองเช่นเดียวกับตอนที่ ١ แต่ใช้สารละลายก
่
รดไฮโดรคลอริกที่มีความเข้มข้น ٠.٣ mol/dm3 ผสมกับนำ้า
กลั่นตามปริมาตรที่กำาหนดในตาราง และใช้สารละลายโซเดียม
ไทโอซัลเฟตเข้มข้น ٠.٣ mol/dm3 ปริมาตรที่คงที่ ١٠ cm3
ตารางกำาหนดปริมาตรของสารละลายกรดไฮโดรคลอริก
และนำำาที่ใช้ในการทดลองตอนที่ ٢
หลอด ปริมาตรของ ปริมาตรของนำำา
ที่ สารละลาย HCI (cm3)
(cm3)
1 10 0
2 8 2
3 6 4
4 4 6
5 2 8
ในการทดลองตอนที่ ١ เมื่อใส่สารละลายโซเดียมไทโอซัลเฟต
٠.٣ mol/dm3 ลงในหลอดที่ ١ โดยไม่มีการเดติมนำ้า ความเข้ม
ข้นของสารละลายในหลอดนี้ยังคงเป็น ٠.٣ mol/dm3 ส่วนหลอด
ที่ ٢ นำาสารละลายโซเดียมไทโอซัลเฟต ٠.٣ mol/dm3 จำานวน ٨
(cm3) มาเติมนำ้าให้เป็น ١٠ (cm3) ความเข้มข้นของสารละลายใน
หลอดคำานวณได้ดังนี้
จำานวนโมลของโซเดียมไทโอซัลเฟตในสารละลาย
โซเดียมไทโอซัลเฟต ٠.٣ mol/dm3 จำานวน ٨ (cm3) เป็นดังนี้
- 3.
เมื่อเติมนำ้า ٢ (cm3)ทำาให้สารละลายมีปริมาตรรวม ١٠
(cm3) ความเข้มข้นของสารละลายโซเดียมไทโอซัลเฟตในหน่วย
เป็นดังนี้
แสดงว่าสารละลายโซเดียมไทโอซัลเฟตในหลอดที่ ٢ มี
ความเข้มข้น ٠.٢٤ mol/dm3 สำาหรับความเข้มข้นของสารละลาย
โซเดียมไทโอซัลเฟตในหลอดอื่นก็คำานวณได้ในทำานองเดียวกัน
เมื่อโซเดียมไทยโอซัลเฟตทำาปฏิกิริยากับกรดไฮโดรคลอริก
จะเกิดปฏิกิริยา ดังสมการ
Na2S2O3(aq) + 2 HCI(aq) → 2NaCl(aq) + H2O(l)
+SO2(g) + S(s)
หรือ
S2O3 ٢-(aq) + 2H+(aq) → H2O(l) + SO2(g) +
S(s)
จากการทดลอง นักเรียนได้วัดระยะเวลาของการเกิด
ปฏิกิริยาตั้งแต่เริ่มต้นจนได้ปริมาณของกำามะถันที่เกิดขึ้นเท่ากัน
คือเมื่อเริ่มมองไม่เห็นเครื่องหมายกากบาท ดังนั้นจึงกล่าวได้วา ่
ปฏิกิริยาของสารในทุกหลอดเริ่มต้นจากจุดเดียวกันและดำาเนินไป
จนถึงจุดหมายปลายทางเดียวกัน อัตราการเกิดปฏิกิริยาเฉลี่ย
เขียนแสดงได้ดังนี้
- 4.
ถ้านำาอัตราการเกิดปฏิกิริยาเฉลี่ยของสารในแต่ละหลอดมา
เปรียบเทียบกันจะเป็นดังนี้
อัตราการเกิดปฏิกิริยาเฉลี่ยของสารในหลอดที่ ١: อัตราการ
เกิดปฏิกิริยาเฉลี่ยของสารในหลอดที่ ٢
เนื่องจากปริมาณของกำามะถันที่เกิดขึ้นในแต่ละหลอดเท่า
กันดังนี้
จากความสัมพันธ์นี้จึงกล่าวได้วา ถ้าต้องการเปรียบเทียบ
่
อัตราการเกิดปฏิกิริยาเฉลี่ยของสรในแต่ละหลอด อาจใช้ส่วน
กลับของระยะเวลาที่สารในแต่ละหลอดเกิดปฏิกิริยามาเปรียบ
เทียบกันได้ สารในหลอดทีใช้ระยะเวลาการเกิดปฏิกิริยาน้อย
่
แสดงว่ามีอัตราการเกิดปฏิกิริยาสูงกว่าสารในหลอดที่ใช้ระยะเวลา
มากกว่า
จากผลการทดลอง จะพบว่าเมื่อให้ความเข้มข้นของ
ไฮโดรเจนไอออนคงที่ แต่เปลี่ยนความเข้มข้นของไทโอซัลเฟต
ไอออน อัตราการเกิดปฏิกิริยาจะเปลียนไอในทำานองเดียวกันการ
่
เปลียนความเข้มข้นของไฮโดรเจนไอออนโดยให้ความเข้มข้นของ
่
ไทโอซัลเฟตคงที่ก็มีผลทำาให้อัตราการเกิดปฏิกิริยาเปลี่ยนแปลง
ด้วย แสดงว่าความเข้มข้นของสารตั้งต้นทั้งสองชนิดในปฏิกิรานี้มี
ผลต่ออัตราการเกิดปฏิกิริยาเคมี
เนื่องจากการเพิ่มหรือลดความเข้มข้นของสารตั้งต้นมีความ
สัมพันธ์กับการเพิ่มหรือลดจำานวนอนุภาคของสารตั้งต้นในระบบ
- 5.
ดังนั้นในกรณีของการเพิ่มความเข้มข้นของสารตั้งต้นระบบเพิ่มขึ้น
โอกาสที่อนุภาคของสารจะเกิดการชนกันจึงมีมากขึ้น (ดังรูป ٦.
٩)และอนุภาคที่มีพลังงานสูงก็มีจำานวนมากขึ้นด้วย จึงมีผลทำาให้
อัตราการเกิดปฏิกิริยามีค่าสูง
โดยทัวไปเราพบว่าการเพิ่มความเข้มข้นของสารตั้งต้นจะมี
่
ผลต่ออัตราการเกิดปฏิกิริยาเคมีอย่างไรก็ตามยังมีบางปฏิกิริยาที่
อัตราการเกิดปฏิกิริยาเคมีขึ้นอยู่กับความเข้มข้นของสารตั้งต้น
ชนิดใดชนิดหนึ่งเท่านั้น หรือบางปฏิกิริยาอัตราการเกิดปฏิกิริยา
เคมีก็ไม่ขึ้นกับความเข้มข้นของสารตั้งต้น กล่าวคืออัตราการเกิด
ปฏิกิริยาจะคงที่ไม่ว่าจะมีสารตั้งต้นมากหรือน้อยเพียงใด เช่น
ปฏิกิริยาการกำาจัดแอลกอฮอล์ออกจากกระแสเลือดในตับ โดย
ปกิตเมื่อมีแอลกอฮอล์เข้าสู่กระแสเลือด ร่างกายจะต้องกำาจัดออก
ทั้งในรูปแอลกอฮอล์โดยตรงและการสลายเป็นสารอื่น อัตราการ
สลายตัวของแอลกอฮอล์เป็นสารอื่นจะมีค่าคงที่ โดยไม่ขึ้นกับ
ปริมาณของแอลกอฮอล์ในเลือดว่ามีอยู่มากน้อยเพียงใด
จากตัวอย่างที่กล่าวมาแล้วถ้าเราทราบชนิดของสารตั้งต้น
และผลิตภัณฑ์ที่เกิดขึ้นในปฏิกิริยา เราสามารถเขียนสมการแสดง
ปฏิกิริยานันได้ แต่ไม่สามารถทำานายอัตราการเกิดปฏิกิริยาได้วา
้ ่
สูงหรือตำ่า และขึ้นอยู่กับความเข้มข้นของสารใดบ้าง ข้อมูลนี้จะ
ได้จากการทดลองเท่านัน ้
2. พืำนที่ผิวของสารกับอัตราการเกิดปฏิกิริยาเคมี
นักเรียนได้ทราบแล้วว่าความเข้มข้นของสารเป็นปัจจัยที่มี
ผลต่อการเกิดปฏิกิริยาเคมี รวมทั้งได้ศึกษาปฏิกิริยาระหว่างลวด
แมกนีเซียมกับกรดไฮโดรคลอลิกมาแล้ว นักเรียนคิดว่าถ้านำา
- 6.
ลวดแมกนีเซียมที่มมวลเท่ากันแต่มีพื้นที่ผวไม่เท่ากันมาทำา
ี ิ
ปฏิกิริยากับกรดไฮโดรคลอริก อัตราการเกิดปฏิกิริยาจะแตกต่าง
กันหรือไม่ อย่างไรศึกษาได้จากการทดลองต่อไปนี้
การทดลอง พืำน ที่ผิวของสารกับการเกิดปฏิกิริยาเคมี
١. ทำาการทดลองเช่นเดียวกับการทดลองที่ ٦.١ แต่เริ่มจับ
เวลาเมื่อสารละลายในกระบอกตวงอยู่ที่ขีด ١cm3 และทุกๆ ١cm3
จนถึง ٥cm3
2. ทำาการทดลองเช่นเดียวกับข้อที่ ١ แต่พับลวดแมกนีเซียม
เหลือความยาวประมาณ ٥ cm3
จากการทดลองพบว่าแมกนีเซียมที่มีมวลเท่ากันแต่มีพื้นผิว
ไม่เท่ากัน มีอัตราการเกิดปฏิกิริยาแตกต่างกัน กล่าวคือ
แมกนีเซียมที่มีพื้นที่ผวมากมีอัตราการเกิดปฏิดิริยาสูงกว่า
ิ
แมกนีเซียมที่มีพื้นผิวน้อย ซึ่งอธิบายไดว่า การที่สารตั้งต้นมีพื้ที่
ผิวมากมีผลให้อนุภาคของสารมีโอกาสเข้าชนกันได้มาก ปฏิกิริยา
จึงเกิดได้เร็วขึ้น
3. อุณหภูมิกับอัตราการเกิดปฏิกิริยาเคมี
เมื่อวางชิ้นโลหะแมกนีเซียมไว้ในอากาศที่อุณหภูมิห้อง ผิว
ของโลหะจะเปลี่ยนเป็นสีเทาช้าๆ เนื่องจากเกิดปฏิกิริกับ
ออกซิเจนในอากาศได้แมกนีเซียมออกไซด์ฉาบอยู่ที่ผิว แต่ถ้านำา
โลหะแมกนีเซียมไปเผาในอากาศจะได้ผงแมกนีเซียมออกไซด์
ภายในเวลาไม่กี่นาที ทำาให้ตั้งข้อสังเกตว่าอุณหภูมิน่าจะเป็นอีก
ปัจจัยหนึ่งที่ทำาให้ปฏิกิริยาเคมีเกิดเร็วหรือช้า การทดลองต่อไปนี้
เป็นการศึกษาว่าการเพิ่มหรือลดของอุณหภูมิมีผลต่ออัตราการเกิด
ปฏิกิริยาเคมีอย่างไร
การทดลอง ٦.٤ อัตราการเกิดปฏิกิริยาระหว่างกรด
ออกซาลิกกับโพแทสเซียมเปอร์แมงกาเนตที่อุณหภูมิต่างๆ
١. ใส่สารละลายกรดออกซาลิก ٠.٠٥ mol/dm3 10 หยด
และสารละลายกรดซัลฟิวริก ١.٠ mol/dm3 ٥ หยด ในหลอด
ทดลองขนาดเล็ก แล้วเติมสารละลายโพแทสเซียมเปอร์แมงกา
เนต ٠.٠٠٥ mol/dm3 ลงไป ١٠ หยด เขย่าและจับเวลาตั้งแต่เติม
- 7.
สารละลายโพแทสเซียมเปอร์แมงกาเนตลงไปจนกระทัง
่
สารละลายเปลี่ยนเป็นไม่มีสี
٢. ทำาการทดลองเช่นเดียวกับข้อ ١ แต่นำาหลอดใส่
สารละลายผสมระหว่างกรดออกซาลิกกับกรดซัลฟิวริกไปแช่นำ้าที่
ควบคุมอุณหภูมิให้คงที่ประมาณ ٦٠ องศา เป็นเวลา ٥ นาที
แล้วจึงเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต เขย่าและจับ
เวลา
٣. ทำาการดลองเช่นเดียวกับข้อ ٢ อีก ٢ ครั้ง โดยควบคุม
อุณหภูมิของนำ้าเป็นประมาณ ٤٠ องศา และ ٢٠ องศา ตามลำาดับ
เมื่อกรดออกซาลิกทำาปฏิกิริยากับสารละลายโพแทสเซียม
เปอร์แมงกาเนตจะเกิดปฏิกิริยาดังสมการ
٥H ٢C ٢O ٤(aq) + 2MnO ٤-(aq) + 6H+(aq) →
10CO ٢(g) + 2Mn2+(aq) + 8H ٢O(l)
ปฏิกิริยาที่เกิดขึ้นนี้ จะสังเกตได้จากการเปลียนสีของ
่
สารละลายจากสีมวงเป็นสีชมพูอ่อน เนื่องจากเปอร์แมงกาเนต
่
ไอออน (MnO ٤) มีสีม่วง เมื่อทำาปฏิกิริยาจะเปลียนไปเป็น
่
แมงกานีส (ΙΙ)ไอออน (Mn ) ซึ่งเป็นสารสีชมพูอ่อน แต่ถ้าเจอ
2+
จามากจะได้สารละลายใสทีไม่มีสี ่
จากการทดลองทำาให้ทราบว่าที่อุณหภูมิสูงปฏิกิริยาเคมีเกิด
ได้เร็วกว่าที่อุณหภูมิตำ่าแสดงว่าอุณหภูมิมีผลต่ออัตราการเกิด
ปฏิกิริยาเคมี กล่าวคือเมื่ออุณหภูมิสูงขึ้นอัตราการเกิดปฏิกิริยาจะมี
ค่าเพิ่มขึ้น และเมื่ออุณหภูมิลดลงอัตราการเกิดปฏิกิริยาจะมีค่า
น้อยลง ตามทฤษฎีจลน์อธิบายได้วา เมื่ออุณหภูมิเพิ่มขึ้น
่
โมเลกุลของแก๊สจะเคลื่อนที่ด้วยอัตราเร็วเพิ่มขึ้น จึงมีอาสที่จะ
ชนกันมากขึ้น ดังนั้นอัตราการเกิดปฏิกิริยาเคมีจึงสูงขึ้น จากการ
คำานวณได้ผลว่าเมื่ออุณหภูมิเพิ่มขึ้น ١٠ องศาเซลเซียส อัตราการ
ชนกันของโมเลกุลเพิ่มขึ้นเพียง ٠.٠١ เท่า แต่ในทางปฏิบัติ
ปรากฏว่าเมื่อเพิ่มอุณหภูมิขึ้น ١٠ องศาเซลเซียส อัตราการเกิด
ปฏิกิริยาจะเพิ่มขึ้น ٣-٢ เท่า นักเรียนคิดว่าเป็นเพราะเหตุใด
- 8.
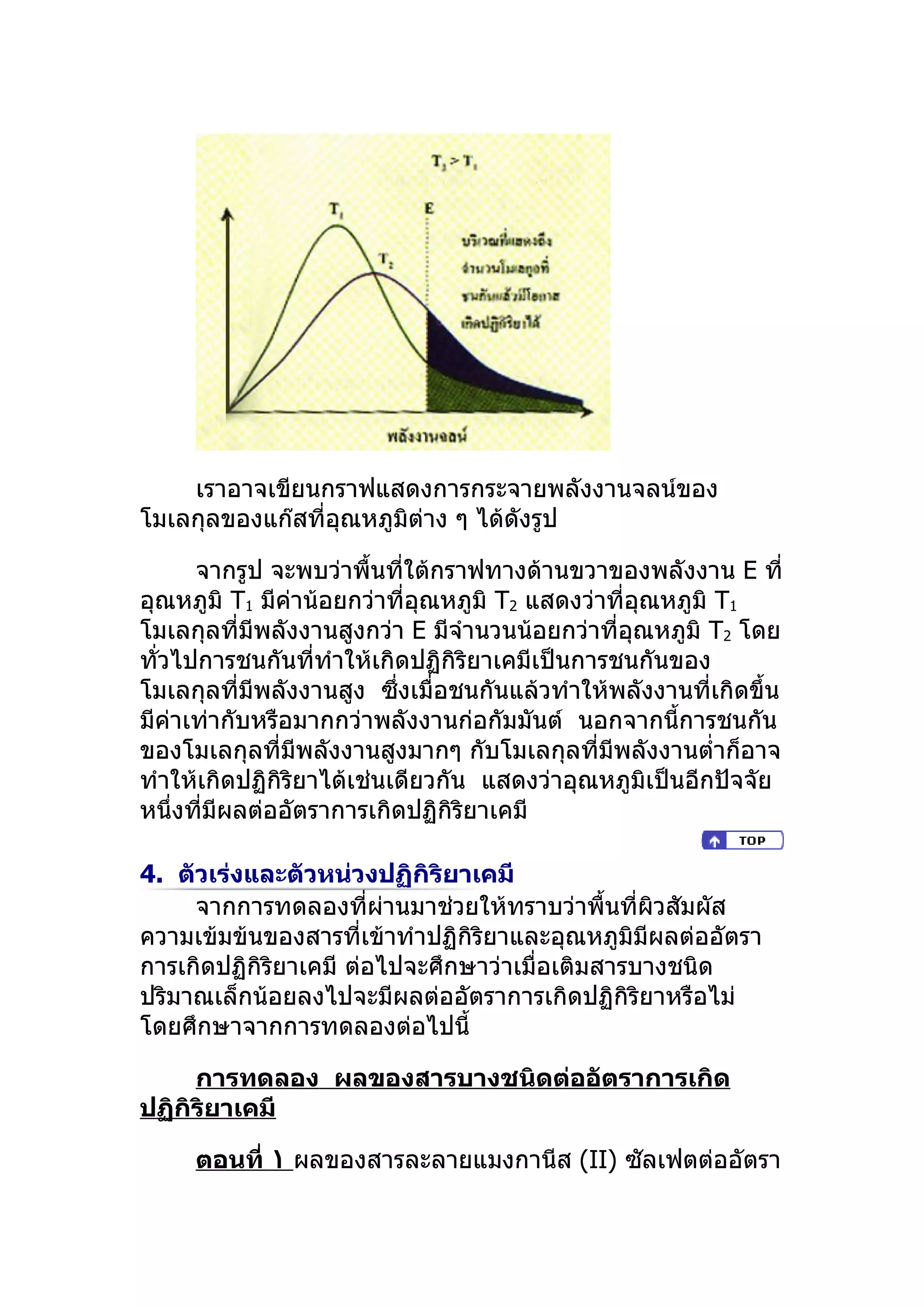
เราอาจเขียนกราฟแสดงการกระจายพลังงานจลน์ของ
โมเลกุลของแก๊สที่อุณหภูมิต่าง ๆ ได้ดังรูป
จากรูป จะพบว่าพื้นที่ใต้กราฟทางด้านขวาของพลังงาน E ที่
อุณหภูมิ T1 มีค่าน้อยกว่าที่อุณหภูมิ T2 แสดงว่าที่อุณหภูมิ T1
โมเลกุลที่มีพลังงานสูงกว่า E มีจำานวนน้อยกว่าที่อุณหภูมิ T2 โดย
ทัวไปการชนกันที่ทำาให้เกิดปฏิกิริยาเคมีเป็นการชนกันของ
่
โมเลกุลที่มีพลังงานสูง ซึ่งเมื่อชนกันแล้วทำาให้พลังงานที่เกิดขึ้น
มีค่าเท่ากับหรือมากกว่าพลังงานก่อกัมมันต์ นอกจากนี้การชนกัน
ของโมเลกุลที่มีพลังงานสูงมากๆ กับโมเลกุลที่มีพลังงานตำ่าก็อาจ
ทำาให้เกิดปฏิกิริยาได้เช่นเดียวกัน แสดงว่าอุณหภูมิเป็นอีกปัจจัย
หนึ่งทีมีผลต่ออัตราการเกิดปฏิกิริยาเคมี
่
4. ตัวเร่งและตัวหน่วงปฏิกิริยาเคมี
จากการทดลองที่ผานมาช่วยให้ทราบว่าพื้นที่ผิวสัมผัส
่
ความเข้มข้นของสารที่เข้าทำาปฏิกิริยาและอุณหภูมิมีผลต่ออัตรา
การเกิดปฏิกิริยาเคมี ต่อไปจะศึกษาว่าเมื่อเติมสารบางชนิด
ปริมาณเล็กน้อยลงไปจะมีผลต่ออัตราการเกิดปฏิกิริยาหรือไม่
โดยศึกษาจากการทดลองต่อไปนี้
การทดลอง ผลของสารบางชนิดต่ออัตราการเกิด
ปฏิกิริยาเคมี
ตอนที่ ١ ผลของสารละลายแมงกานีส (II) ซัลเฟตต่ออัตรา
- 9.
การเกิดปฏิกิริยาระหว่างสารละลายโพแทสเซียมเปอร์แมงกาเนต
กับสารละลายกรดออกซาลิก
١. นำาหลอดทดลองขนาดกลางมา ٢ หลอด แต่ละหลอดใส่
สารละลายกรดออกซาลิก ٠.٠٥ mol/dm3 จำานวน ٢ cm3 และ
สารละลาย กรดซัลฟิวริก ١.٠ mol/dm3 จำานวน ١ cm3
٢. นำาหลอดที่ ١ มาเติมสารละลายโพแทสเซียมเปอร์แมงกา
เนต ٠.٠٠٥ mol/dm3 จำานวน ٢ cm3 เขย่าพร้อมทั้งเริ่มจับเวลา
จนกระทั่งสารละลายเปลี่ยนเป็นไม่มีสี
٣. นำาหลอดที่ ٢ มาเติมสารละลายโพแทสเซียมเปอร์แมงกา
เนต ٠.٠٠٥ mol/dm3 จำานวน ٢ cm3 และสารละลายแมงกานีส
(ΙΙ) ซัลเฟต ٠.١ mol/dm3 จำานวน ٥ หยด เขย่าพร้อมทังเริ่มจับ
้
เวลาจนสารละลายเปลี่ยนเป็นไม่มีสี
ตอนที่ ٢ ผลของโซเดียมฟลูออไรด์ต่ออัตราการเกิด
ปฏิกิริยาระหว่างเปลือกไข่กับสารละลายกรดแอซีติก
1. ใส่เปลือกไข่ที่ตกแห้งและบดละเอียดลงในหลอด
ทดลองขนาดกลาง ٢ หลอด ๆ ละ ١ g
2. ใส่ผงโซเดียมฟลูออไรด์ ٠.١ g ลงบนเปลือกไข่ในข้อ ١
เพียง ١ หลอด คลุกเคล้าให้ทว
ั่
3. นำาหลอดทดลองจากข้อ ١ และจากข้อ ٢ มาเติม
สารละลายกรดแอซีติก ٠.٥ mol/dm3 หลอดละ ٣ cm3
สังเกตการณ์เปลี่ยนแปลง
เมื่อเติมสารบางชนิดปริมาณเล็กน้อยลงไปแล้วทำาให้
ปฏิกิริยาเคมีเกิดได้เร็วขึ้น สารที่เติมลงไปนี้เรียกว่า ตัวเร่ง
ปฏิกิริยา แสดงว่าในการทดลอง ตอนที่ ١ แมงกานีส (ΙΙ)
ซัลเฟต ทำาหน่วงที่เป็นตัวเร่งปฏิกิริยาระหว่างสารละลายกรดออก
ซาลิกกับสารละลายโพแทสเซียมเปอร์แมงกาเนต ส่วนสารที่เติม
ลงไปแล้วทำาให้ปฏิกิริยาเคมีเกิดชาลงเรียกว่าตัวหน่วงปฏิกิริยา
จากผลการทอลองตอนที่ ٢ ปฏิกิริยาชองสารในหลอดที่เติมโซ
เดียมฟลูออไรด์เกิดช้ากว่า จึงกล่าวได้วาโซเดียมฟลูออไรด์เป็น
่
- 10.
ตัวหน่วงปฏิกิริยา จากผลการทดลองที้งสองตอนสรุปได้ว่าตัวเร่ง
ปฏิกิริยาและตัวหน่วงปฏิกิริยามีผลทำาให้อัตราการเกิดปฏิกิริยา
เปลียนแปลงได้
่
จากการศึกษาที่ผ่านมาได้เปรียบเทียบการเกิด
ปฏิกิริยาเคมีกับการเดินทางข้ามภูเชา และพลังงานกอกัมมันต์
เปรียบได้กับความสูงของภูเขา ถ้าภูเขาสูงมากคนที่มีกำาลังมากพอ
เท่านั้นจึงจะผ่านไปได้ แต่เมื่อมีการใช้ตัวเร่งปฏิกิริยาซึ่งเปรียบ
เสมือนการเดินทางสายใหม่ที่ไปถึงจุดหมายปลายทางได้ อีกทั้ง
ข้ามภูเขาไม่สูงมากหรือกล่าวได้ว่ามีพลังงานก่อกัมมันต์ของ
ปฏิกิริยานันลดตำ่าลง ทำาให้คนที่จะเดินทางไปถึงจุดหมายปลาย
้
ทางมีจำานวนเพิ่มมากขึ้น นั่นคือโมเลกุลที่ชนกันแล้วมีพลังงานสูง
กว่าพลังงานก่อกัมมันต์จะมีจำานวนมากกว่าเมื่อมี่มีตัวเร่งปฏิกิริยา
จึงเป็นผลให้อัตราการเกิดปฏิกิริยาสูงขึ้น ความสัมพันธ์ระหว่าง
พลังงานจลน์กับจำานวนโมเลกุลซึ่งมใพลังงานสูงกว่าพลังงานก่
อกัมมันต์ในกรณีที่มีและไม่มีตัวเร่งปฏิกิริยาแสดงได้ดังรูป
- 11.
ในปฏิกิริยาที่มีตัวเร่งปฏิกิริยาอยู่นั้น เมื่อปฏิกิริยาสิ้น
สุดแล้ว สมบัติของตัวเร่งปฏิกิริยาจะเป็นอย่างไรศึกษาได้จาก
การทดลองต่อไปนี้
การทดลอง สมบัติของตัวเร่งปฏิกิริยา
١. ใส่โซเดียมโพแทสเซียมทาร์เทรต ٠.٥ g ในหลอด
ทดลองขนาดกลาง เติมนำ้าเดือด ٥ cm3 เขย่าจนสารละลายหมด
แล้วแบ่งสารละลายครึ่งหนึ่งใส่ในหลอดทดลองขนาดกลางอีก
หลอดหนึ่ง
٢. เติมสารละลายไฮโดรเจนเปอร์ออกไซด์เข้มข้นร้อยละ ٦
จำานวน ٣ cm3 ลงในแต่ละหลอดพร้อมกัน
٣. เติมสารละลายโคบอลต์ (ΙΙ) คลอไรด์ ٠.١ mol/dm3 -٢
٣ หยด ลงในหลอดทดลองที่ ١
٤. เขย่าหลอดทดลองทั้งสองเบา ๆ ตลอดเวลาสังเกตการณ์
เปลียนแปลง
่
สารละลายโคบอลต์ (ΙΙ) คลอไรด์มีสีชมพู ขณะเกิด
ปฏิกิริยาจะเปลี่ยนเป็นสีเขียวและเมื่อปฏิกิริยาสิ้นสุดลงจะกลับเป็น
สีชมพูเหมือนเดิม แสดงว่าขณะที่ปฏิกิริยาดำาเนินไปตัวเร่ง
ปฏิกิริยาจะเข้าไปมีสวนร่วมในปฏิกิริยาด้วยโดยเปลี่ยแปลงเป็น
่
สารอื่นชั่วขณะหนึ่ง แต่เมื่อปฏิกิริยาสิ้นสุดแล้วจะกลับเป็นสารเดิม
การที่จะทราบว่าตัวเร่งปฏิกิริยาเข้าไปมีส่วนร่วมในปฏิกิริยา
- 12.
อย่างไรนั้นจะได้ศึกษาในขั้นสูงต่อไป
ตัวเร่งปฏิกิริยามีประโยชน์มากทั้งในชีวิตประจำาวัน
และในกระบวนการอุตสาหกรรม เช่น การย่อยอาหารในร่างกายใช้
เอนไซม์หลายชนิดเป็นตัวเร่งปฏิกิริยา การผลิตแอมโมเนีใช้เหล็ก
เป็นตัวเร่งปฏิกิริยา ในกระบวนการเติมไฮโดรเจนแก่สารอินทรีย์ใช้
นิกเกิลเป็นตัวเร่งปฏิกิริยา และในกระบวนการแตกสลาย
ไฮโดรคาร์บอนในการกลั่นนำ้ามันใช้ซิลิคอนไดออกไซด์และ
อะลูมิเนียมออกไซด์เป็นตัวเร่งปฏิกิริยาการใช้ตัวเร่งปฏิกิริยาเพื่อ
ช่วยให้ปฏิกิริยาเกิดเร็วขึ้นต้องคำานึงถึงปัจจัยหลายอย่าง เช่น
ความปลอดภัย ความยากง่ายในการแยกตัวเร่งปฏิกิริยาออกจาก
ผลิตภัณฑ์ และราคาของตัวเร่งปฏิกิริยา
สำาหรับตัวหน่วงปฏิกิริยา นอกจากโซเดียมฟูลออไรด์
ซึ่งเป็นตัวหน่วงปฏิกิริยาระหว่างกรดแอซีติกกับแคลเซียม
คาร์บอเนตจากเปลือกไข่แล้ว ยังมีสารอื่นอีกทีทำาหน้าที่เป็นตัว
่
หน่วงปฏิกิริยา เช่น ปฏิกิริยาสลายตัวของไฮโดรเจนเปอร์
ออกไซด์ได้นำ้าและแก๊สออกซิเจนดังสมการ
٢H2O2(l) → 2H2O(l) + O2(g)
เมื่องเติมกรดไฮโดรคอลริกเจือจางหรือกลีเซอรอล
ลงไปเล็กน้อย จะทำาให้ไฮโดรเจนเปอร์ออกไซด์สลายได้ช้าลง
จากผลการทดลอง และความรูที่ได้ศึกษามาแล้ว
้
สามารถสรุปปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมีได้ดังนี้
1. ปฏิกิริยาเคมีส่วนใหญ่เมื่อเพิ่มความเข้มข้นของสารตั้ง
ต้นปฏิกิริยาจะเกิดเร็วขึ้น และเมื่อลดความเข้มข้นของสาร
ตั้งต้นปฏิกิริยาจะเกิดช้าลง
2. สารที่มีพื้นที่ผวมากจะเกิดปฏิกิริยาเคมีเร็วกว่าสารที่มี
ิ
พื้นที่ผิวน้อย
3. การเพิ่มอุณหภูมิจะทำาให้ปฏิกิริยาเกิดเร็วขึ้นและการลด
อุณหภูมิจะทำาให้ปฏิกิริยาเกิดช้าลง
- 13.