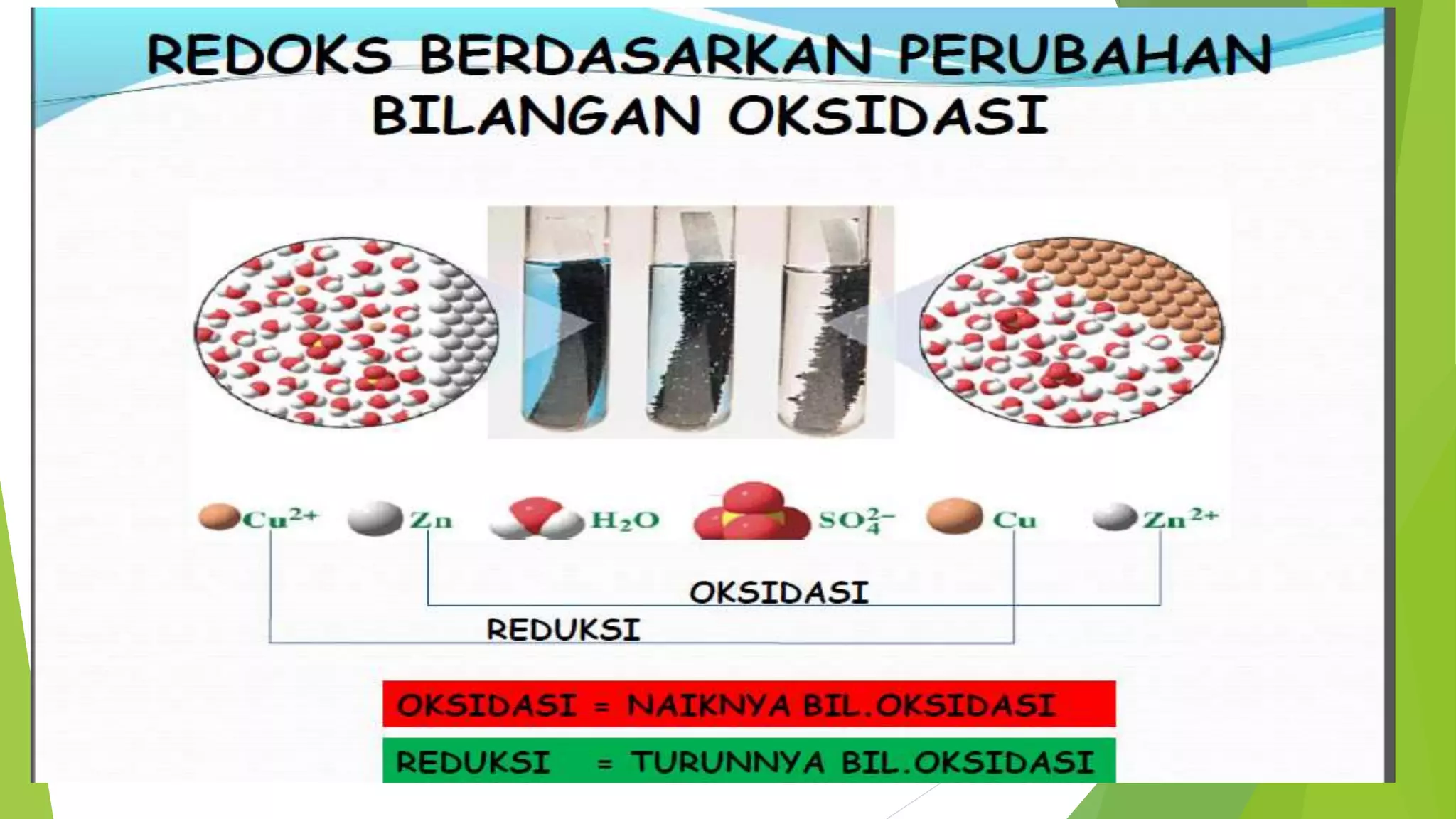
Bilangan oksidasi adalah angka hipotesis yang menunjukkan jumlah elektron yang dimiliki suatu atom atau ion dalam senyawa, dan dapat berupa positif, negatif, atau nol. Terdapat aturan untuk menentukan bilangan oksidasi, seperti yang berlaku pada unsur-unsur golongan tertentu dan jumlah total bilangan oksidasi dalam suatu senyawa umumnya adalah nol. Contoh perhitungan diberikan untuk menghitung bilangan oksidasi dalam senyawa seperti KClO4 dan Cr2O7.