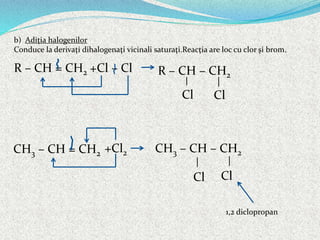
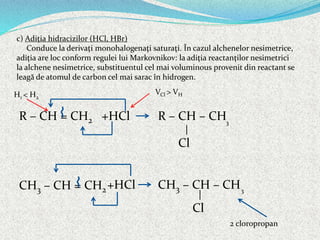
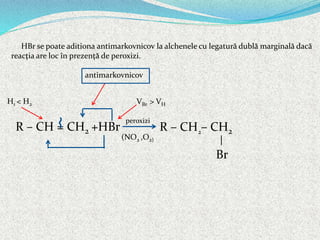
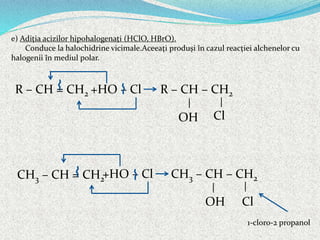
Alchenele sunt hidrocarburi nesaturate cu formula generală CnH2n, caracterizate printr-o legătură dublă între atomii de carbon hibridați sp2. Aceștia pot prezenta izomerie de catenă, poziție și funcțiune, precum și izomerie geometrică (cis-trans, E-Z). Reacțiile alchenelor includ adiția, substituția și polimerizarea, având proprietăți fizice și chimice distincte, cum ar fi solubilitatea în solvenți organici și comportamentul în reacțiile de oxidare.











![nCH2 = CH2
polimerizare
CH2 – CH2
– –
n
polietenă
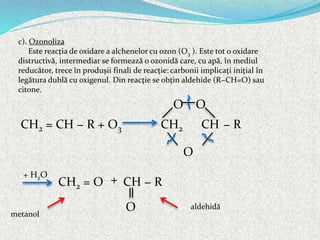
4). Reacţia de oxidare
a).Oxidarea blândă
Se realizează cu oxigenul atomic ([O]) provenit dintr-o soluţie slab bazică de
permanganat de potasiu (KMnO4). Mediul slab bazic este asigurat de carbonatul de
natriu (Na2CO3). Soluţia slab bazică de permanganat de potasiu se numeşte reactiv
Bayer. La oxidarea blândă a alchenei se rupe legătura π din legătura dublă şi din
reacţie se obţin dioli vicinali (compuşi care au două grupări OH pe carboni vecini).](https://image.slidesharecdn.com/alchene-150422143215-conversion-gate02/85/Alchene-prezentare-19-320.jpg)
![KMnO4 +H2O
NaCl
KOH+ Mn O2 + [O]2 2 2 3
R – CH = CH2 + [O] + H2O
KMnO4
Na2CO3
R – CH – CH2
OH OH
3 x
R – CH = CH2 + KMnO4+ H2O R – CH – CH2 + KOH+ Mn O2
OH OH
3 2 4 3 2 2
CH3 – CH = CH2 + [O] + H2O
KMnO4
Na2CO3
CH3 – CH – CH
OH OH
1,2 propan-diol](https://image.slidesharecdn.com/alchene-150422143215-conversion-gate02/85/Alchene-prezentare-20-320.jpg)

![KMnO4 + H2SO4 K2SO4 + MnSO4 + H2O + [O]2 3 5
CH2 = CH − R + [O]
KMnO4
H2SO4
CO2+H2O + R − COOH5
CH2 = C − R + [O]
R
KMnO4
H+
CO2+H2O + C − R
R
O
cetonă
4](https://image.slidesharecdn.com/alchene-150422143215-conversion-gate02/85/Alchene-prezentare-22-320.jpg)
![R − CH = CH − R’ + [O] R − COOH+HOOC − R’
(R’ − COOH)
4
R − CH = C − R + [O]
R’
K2C2O7
H+
R − COOH + C − R
R’
O
R − C = C − R’ + [O]
R R’
K2C2O7
H+
R − C = O
R
+ O = C − R’
R’](https://image.slidesharecdn.com/alchene-150422143215-conversion-gate02/85/Alchene-prezentare-23-320.jpg)