Dokumen ini membahas unsur-unsur periode ketiga, mencakup sifat fisik dan kimia dari natrium, magnesium, aluminium, silikon, fosfor, belerang, klor, dan argon, serta kegunaannya dalam kehidupan sehari-hari. Dijelaskan pula proses pembuatan setiap unsur dan reaksi kimia yang mungkin terjadi. Tabel perbandingan sifat unsur juga disertakan untuk mempermudah perbandingan karakteristik masing-masing unsur.



![Sifat Fisis
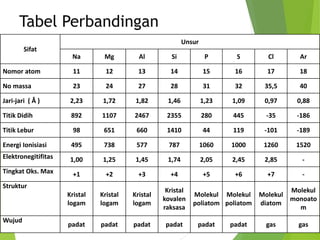
Nomor atom : 11
Konfigurasi e- : [Ne] 3s1
Massa Atom relatif :
22,98977
Jari-jari atom : 2,23 Å
Titik Didih : 892 C
Titik Lebur : 495 C
Elektronegatifitas: 1
Energi Ionisasi : 495 kJ/mol
Tingkat Oks. Max : 1+
Struktur Atom : Kristal
Logam
Wujud : Padat
Natrium (Na)
Sifat Kimia
Merupakan logam lunak, bewarna putih
keperakan, reaktif
Bereaksi dengan cepat dengan air
membentuk sodium hidroksida dan
hidrogen
Dapat bereaksi dengan Alkohol namun
lebih lambat dibanding dengan air
Tidak bereaksi terhadap nitrogen
Merupakan komponen terbesar kedua
yang larut di air laut
Mudah ditemui pada sumber air alami](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-4-320.jpg)

![Magnesium (Mg)
Sifat Fisis
Nomor atom : 12
Konfigurasi e- : [Ne] 3s2
Massa Atom relatif :
24,305
Jari-jari atom : 1,72 Å
Titik Didih : 1107 C
Titik Lebur : 651 C
Elektronegatifitas: 1,25
Energi Ionisasi : 738 kJ/mol
Tingkat Oks. Max : 2+
Struktur Atom : Kristal
Logam
Wujud : Padat
Sifat Kimia
Termasuk unsur reaktif. Sebagian besar
logam dapat dihasilkan dengan bantuan
magnesium. Banyak ditemukan di alam
dan dalam mineral : dolomite,
magnetite, olivine, serpentine. Senyawa
yang terbentuk umumnya ikatan ion,
namun ada juga berupa ikatan kovalen](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-6-320.jpg)

![Aluminium (Al)
Sifat Fisis
Nomor atom : 13
Konfigurasi e- : [Ne] 3s2 3p1
Massa Atom relatif :
26,98154
Jari-jari atom : 1,82 Å
Titik Didih : 2467 C
Titik Lebur : 660 C
Elektronegatifitas: 1,45
Energi Ionisasi : 577 kJ/mol
Tingkat Oks. Max : 3+
Struktur Atom : Kristal
Logam
Wujud : Padat
Sifat Kimia
Berupa logam lunak bewarna perak
Merupakan penghantar panas yang
sangat baik dan dapat menghantarkan
listrik
Sulit terkorosi karena membentuk
lapisan oksida di permukaannya
Tidak beracun, non-magnetik dan sulit
terbakar
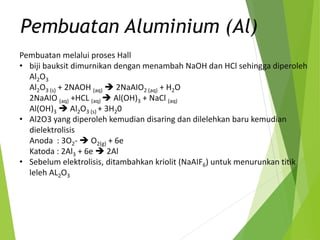
Sumber utamanya adalah biji bauksit
Senyawa Penting](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-8-320.jpg)

![Silikon (Si)
Sifat Fisis
Nomor atom : 14
Konfigurasi e- : [Ne] 3s2 3p2
Massa Atom relatif :
28,0855
Jari-jari atom : 1,46 Å
Titik Didih : 2355 C
Titik Lebur : 1410 C
Elektronegatifitas: 1,74
Energi Ionisasi : 787 kJ/mol
Tingkat Oks. Max : 4+
Struktur Atom : Kristal
Kovalen
raksasa
Wujud : Padat
Sifat Kimia
Merupakan unsur elektropositif yang
paling banyak dijumpai. Isotop alaminya
terdiri atas isotop 28 (92,2%), isotop 29
(4,7%), isotop 30 (3,1%). Memiliki sifat
kimia seperti logam yang
lain.Kemampuan semikonduktor akan
meningkat jika ditambahkan pengotor
suhu.
Senyawa Penting](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-11-320.jpg)

![Fosfor (P)
Sifat Fisis
Nomor atom : 15
Konfigurasi e- : [Ne] 3s2 3p3
Massa Atom relatif :
30,97376
Jari-jari atom : 1,23 Å
Titik Didih : 280 C
Titik Lebur : 44 C
Elektronegatifitas: 2,05
Energi Ionisasi : 1060 kJ/mol
Tingkat Oks. Max : 5+
Struktur Atom : molekul
Poliatom
Wujud : Padat
Sifat Kimia
Secara umum fosforus membentuk
padatan putih yang lengket yang
memiliki bau yang tak enak tetapi ketika
murni menjadi tak berwarna dan
transparan. Nonlogam ini tidak larut
dalam air, tetapi larut dalam karbon
disulfida. Fosforus murni terbakar secara
spontan di udara membentuk fosforus
pentoksida.
Senyawa Penting](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-13-320.jpg)

![Sulfur (S)
Sifat Fisis
Nomor atom : 16
Konfigurasi e- : [Ne] 3s2 3p4
Massa Atom relatif :
32,066
Jari-jari atom : 1,09 Å
Titik Didih : 445 C
Titik Lebur : 119 C
Elektronegatifitas: 2,45
Energi Ionisasi : 1000 kJ/mol
Tingkat Oks. Max : 6+
Struktur Atom : molekul
poliatom
Wujud : Padat
Sifat Kimia
• Zat murninya tidak berbau dan tidak
berasa
• Memiliki struktur yang beragam,
tergantung konsisi sekitar
• Secara alami banyak terdapat di
gunung berapi
• Komponen murninya tidak beracun
namun senyawa yang terbentuk
kebanyakanberbahaya bagi manusia
• Senyawa sulfur yang utama adalah
SO2, dan SO3. SO2 berupa gas yang
mudah larut dalam air sehigga
menyebabkan hujan asam
• Efek yang ditimbulkan dapat sikurangi
dengan cara melewatkan air yang
terkontaminasi pada padatan CaCO3.
Senyawa Penting](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-15-320.jpg)

![Chlor (Cl)
Sifat Fisis
Nomor atom : 17
Konfigurasi e- : [Ne] 3s2 3p5
Massa Atom relatif :
35,4527
Jari-jari atom : 0,97 Å
Titik Didih : -35 C
Titik Lebur : -101 C
Elektronegatifitas: 2,85
Energi Ionisasi : 1260 kJ/mol
Tingkat Oks. Max : 7+
Struktur Atom : molekul
diatom
Wujud : gas
Sifat Kimia
Merupakan gas diatomik bewarna
kehijauan
Termasuk gas yang beracun
Dalam bentuk padat dan cair merupakan
oksidator yang kuat
Mudah bereaksi dengan unsur lain
Merupakan zat yang paling banyak
terkandung di air laut
Terdapat juga dalam carnalite dan
silvite](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-17-320.jpg)

![Argon (Ar)
Sifat Fisis
Nomor atom : 18
Konfigurasi e- : [Ne] 3s2 3p6
Massa Atom relatif :
39,948
Jari-jari atom : 0,88 Å
Titik Didih : -186 C
Titik Lebur : -189 C
Elektronegatifitas: -
Energi Ionisasi : 1520 kJ/mol
Tingkat Oks. Max : -
Struktur Atom : molekul
monoatom
Wujud : gas
Sifat Kimia
Merupakan gas yang tidak bewarna dan
berasaTidak reaktif seperti halnya gas
mulia yang lain. Dapat diperoleh dengan
cara memaskan udarea dengan CaC2
Terdapat sekitar 1% argon di atmosfer
Terbentuk di atmosfer sebagai akibat
dari proses sinar kosmik](https://image.slidesharecdn.com/pptperiodeke-3fix-170930224817/85/Ppt-unsur-periode-ke-3-fix-19-320.jpg)