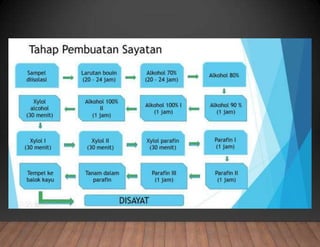
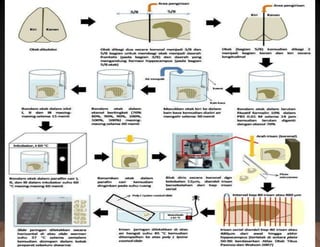
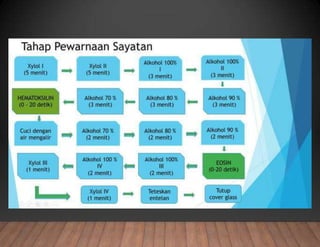
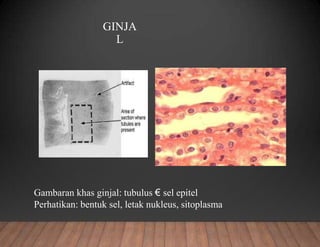
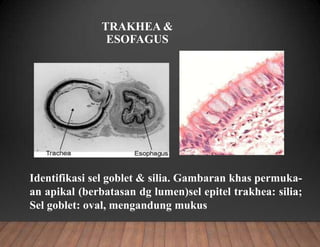
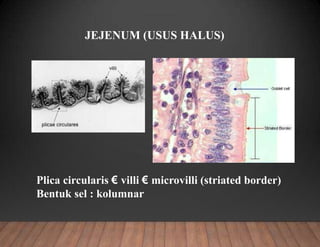
Dokumen tersebut membahas tentang pembuatan sediaan histologi dengan cara parafin, meliputi tahapan pengambilan sampel jaringan, fiksasi, dehidrasi, penjernihan, pemancangan, pemotongan, penempelan, deparafinisasi, pewarnaan, dan pengamatan di bawah mikroskop. Tahapan tersebut bertujuan memperoleh irisan jaringan yang tipis dan rata serta dapat mempertahankan struktur jaring