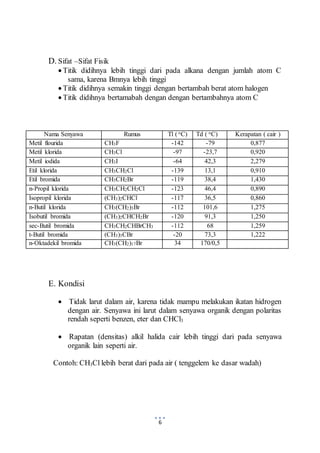
Alkil halida adalah turunan hidrokarbon yang hidrogennya diganti dengan halogen, dengan potensi stabilitas tinggi dan keberagaman biologis. Dokumen ini membahas pengertian, tata nama, sifat fisik, dan reaksi-reaksi yang melibatkan alkil halida, serta kegunaannya dalam kehidupan sehari-hari seperti dalam pelarut dan insektisida. Kesimpulan menyatakan bahwa alkil halida memiliki isomer dan termasuk dalam kategori senyawa yang mengandung karbon, hidrogen, dan halogen.