Halogen dan Senyawa Halogen
Florin (F) & Klorin (Cl)
Peatty Winona Zerlinda S.
Ringkasan:
Dokumen ini membahas tentang halogen khususnya fluorin dan klorin. Menguraikan ciri kimia dan sifat atomik fluorin dan klorin serta penjelasan tentang proses pembuatan dan manfaat kedua unsur tersebut.


![Fluorin (F)
9
Fluorin (F)
[He] 2s22p5
19
Ditemukan oleh Schwandhard tahun
1670 dan diisolasi oleh Maisson tahun
1886
Di alam terdapat dalam senyawa
fluorspar [CaF2], kriolit [Na3AIF6], dan
fluorapatit [Ca5(PO4)3F]
Ciri-ciri: berwujud gas, berbau pedas,
berwarna kuning muda pucat, bersifat
sangat korosif.
4](https://image.slidesharecdn.com/halogen-flourinklorin1376d-131123225347-phpapp02/75/Halogen-flourin-klorin-peatty-4-2048.jpg)
![Fluorin (F)
Didapat dari alam melalui elektrolisis
lelehan campuran KF dan HF.
Katode:K+(l) + e- → K(l)
Anode: F-(l) → F2(g) + e Manfaat: zat lapis anti lengket panci
(CF2CF2), pencegah gigi rusak pada pasta
gigi, sebagai zat pendingin [CCl2F2] (freon-12)
pada lemari es dan AC
5](https://image.slidesharecdn.com/halogen-flourinklorin1376d-131123225347-phpapp02/75/Halogen-flourin-klorin-peatty-5-2048.jpg)

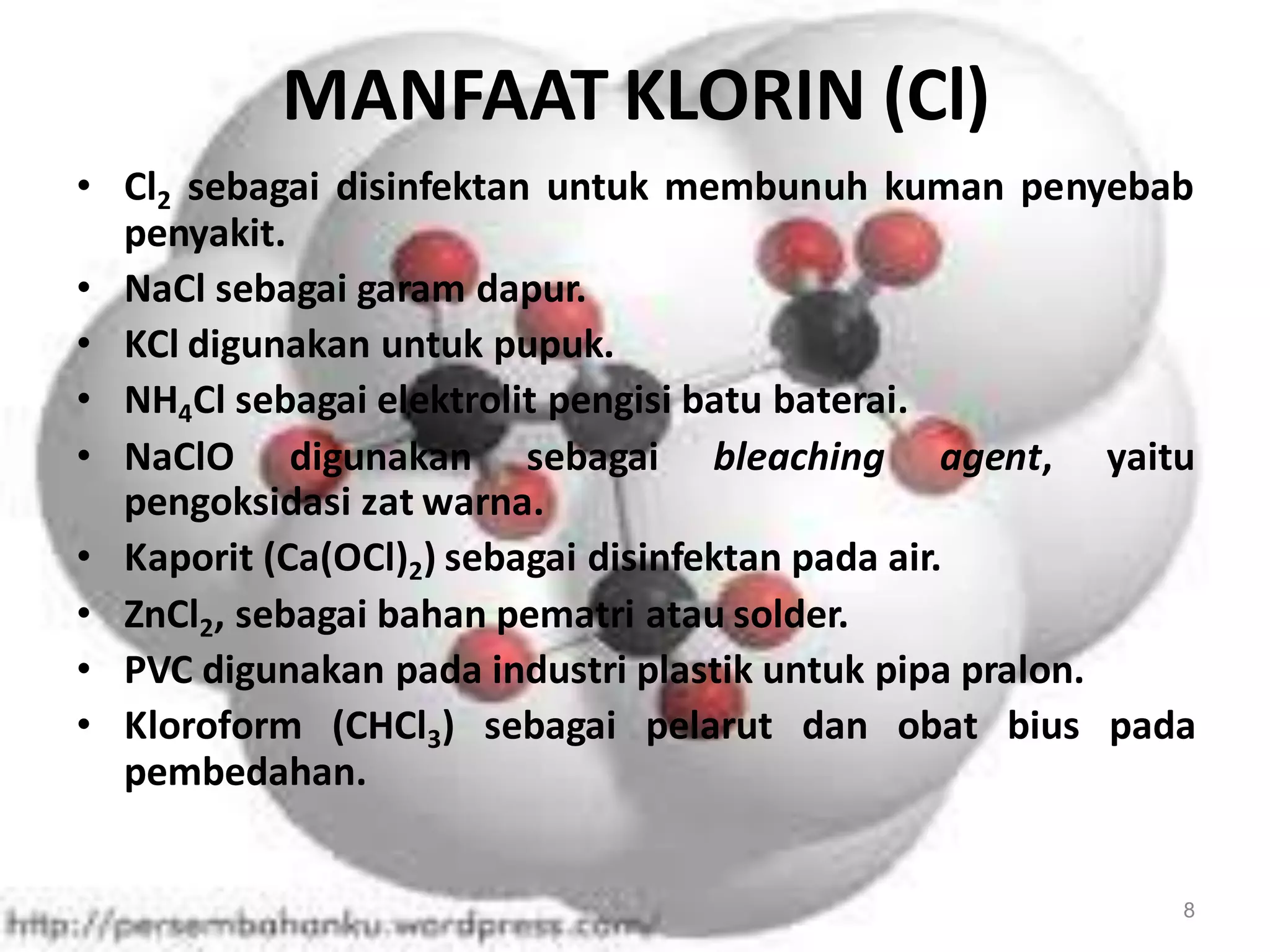
![17
Klorin (Cl)
Klorin (Cl)
[He] 2s22p5
35,5
Ditemukan oleh Scheele tahun 1774 dan
diberi nama oleh Davy tahun 1810.
Ciri-ciri: wujudnya gas, berwarna kuning
kehijauan, larut dalam air, mudah bereaksi.
Didapat dari alam melalui elektrolisis air laut
dan atau garam batu.
2NaCl(aq) + 2H2O(l) → H2(g) + Cl2(g) + 2NaOH-(aq)
7](https://image.slidesharecdn.com/halogen-flourinklorin1376d-131123225347-phpapp02/75/Halogen-flourin-klorin-peatty-7-2048.jpg)