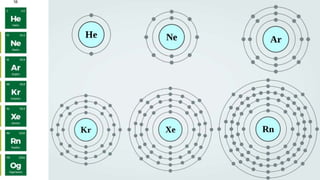
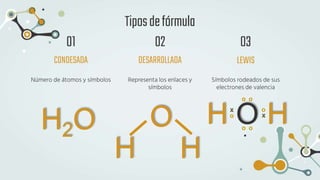
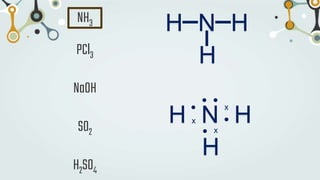
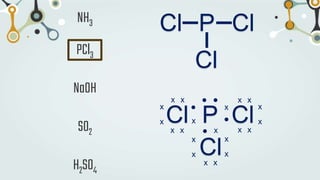
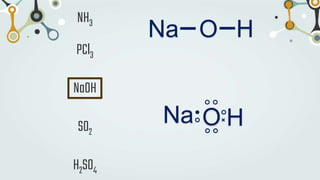
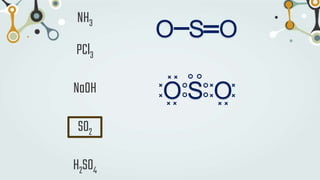
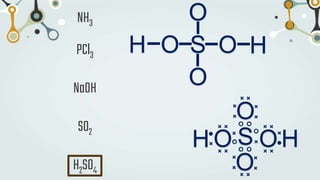
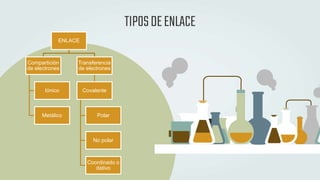
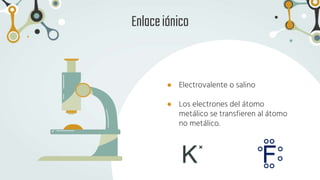
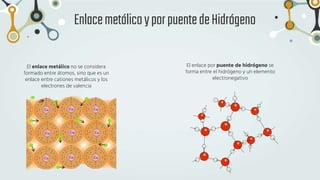
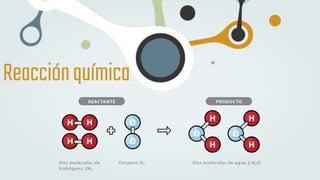
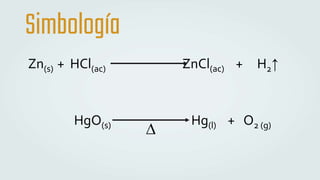
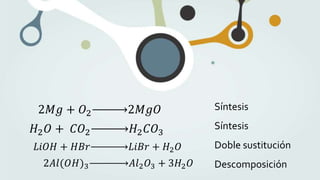
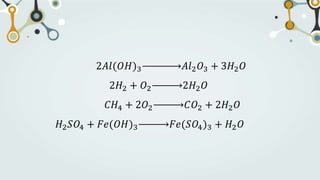
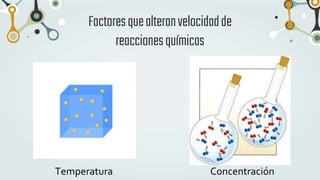
The document discusses different types of chemical bonds and chemical reactions. It describes how atoms bond through electron sharing or transfer, forming ionic, covalent, or metallic bonds. Covalent bonds can be polar or nonpolar depending on electronegativity differences. It also defines exothermic and endothermic reactions, and describes synthesis, substitution, and decomposition reaction types through examples.