Dokumen tersebut memberikan informasi mengenai:
1. Daftar nama kelompok mahasiswa beserta jumlahnya yang terdiri atas 13 orang
2. Penjelasan singkat mengenai senyawa alkena seperti struktur, sifat fisika, sifat kimia, dan contoh penggunaannya
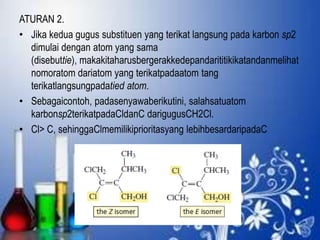
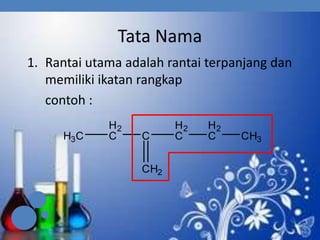
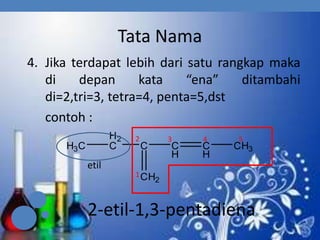
3. Aturan penamaan dan jenis-jenis isomer yang dimiliki oleh senyawa alkena