More Related Content
PPTX
DOC
DOCX
катионуудыг таних чанарын чанарын урвалууд PPTX
ODP
PPTX
PPT
PPT
What's hot
PPTX
DOC
PPTX
Бодис болон энергийн солилцоо PPTX
DOCX
PPT
DOCX
DOC
PPTX
PPT
PPTX
PPTX
эсийн мембрант бүтэцгүй эрхтэнцэрүүд PPTX
ODP
8 р анги нийлмэл бодис нэгж PPT
PPTX
DOCX
PDF
PPTX
PPTX
зөвлөгөө өгөх үндсэн зарчим Similar to 4 р бүлгийн р элементүүд
PPTX
PDF
DOCX
PPTX
Tsewerlex arga 1 r bair amjilt PPTX
PDF
DOC
DOCX
PPT
ODP
PPTX
DOCX
ODP
PPTX
химийн туршилтын арга техник DOCX
Ximi 9 r angi angiin daalgavar DOCX
органик химийн хөгжлийн тойм ODT
баттуяа хэрэглэгдэхүүн химийн жишиг даалгавар PDF
PDF
PDF
More from Khishighuu Myanganbuu
PPTX
2 цэгийн хоорондох зай Огторгуйн координатын систем PPTX
Тэгшитгэл 9-р анги. хялбар тэгшитгэл тэнцэтгэл биш PPTX
Квадрат Функцын график байгуулах дасгал. PPTX
Тэгшитгэл бодох аргуудыг сураарай please PDF
PDF
PPTX
PPTX
DOCX
PDF
PDF
PPT
нуугдсан файл болон фолдертой ажиллах PPTX
персональ компьютерийн архитектур PPTX
функц шинжлэх график байгуулах PPTX
PPTX
PPTX
тригонометр тэгшитгэл бодох аргууд DOCX
PPTX
тригонометр тэнцэтгэл биш 2 PPTX
4 р бүлгийн р элементүүд
- 1.
- 2.
Энэ бүлэгтнүүрстөрөгч
цахиур, германи, цагаан тугалга, хар
тугалга зэрэг элемент багтана.
Нүүрстөрөгч цахиур нь металл
биш, дараах 3-н элемент нь металлууд
юм.
Гадаад давхраа 4-н электронтой. Энэ нь
эдгээр элементүүд хоорондоо төсөөтэй
байдгийн гол үндэс болно.
Элементийн дэс дугаар ихсэх тутам
атомын радиус ихсэж металл биш шинж
суларч металл шинж нь ихсэнэ.
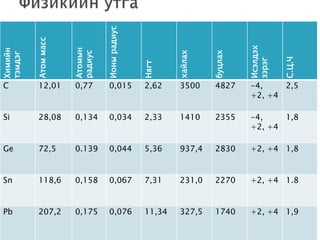
- 3.
Ионы радиус
Атом масс
Исэлдэх
Атомын
Химийн
хайлах
буцлах
радиус
тэмдэг
С.Ц.Ч
зэрэг
Нягт
C 12,01 0,77 0,015 2,62 3500 4827 -4, 2,5
+2, +4
Si 28,08 0,134 0,034 2,33 1410 2355 -4, 1,8
+2, +4
Ge 72,5 0.139 0,044 5,36 937,4 2830 +2, +4 1,8
Sn 118,6 0,158 0,067 7,31 231,0 2270 +2, +4 1.8
Pb 207,2 0,175 0,076 11,34 327,5 1740 +2, +4 1,9
- 4.
Нүүрстөрөгч (С)
Дэс дугаар 6
Атом масс 12.01 г/моль
Өнгө: Хар (Бал чулуу), Өнгөгүй
(Алмаз)
Электрон байгуулалт: 2s²,2p²
Нүүрстөрөгч нь алмаз, бал чулуу,
карбин, фуллерин 4 аллотроп
дүрс хувиралтай.
- 5.
Нүүрс төрөгч+4,+2,-4 гэсэн исэлдэх
зэргийг үзүүлнэ.
Электрон давхраандаа 4 электронтой.
Гадна давхрагадаа 2 хослоогүй
электронтой учир ерийн үед 2 валент
үзүүлнэ.
Өдөөгдсөн байдалдаа 4 сондгой
электронтой болох тул 4 валентийг
үзүүлнэ.
- 6.
Нүүрстөрөгчийн атомднэг S, гурван
р-электрон (өдөөгдсөн төлөвт)
оршино. Энэ үед sp, sp² ,sp³
орбиталууд үүснэ.
Sp-эрлийзжилт-шугаман
sp² -эрлийзжилт-гурвалжин
sp³-эрлийзлжилт-тетраэдр
байрлалтай.
- 7.
Нүүрстөрөгч ньбайгальд дан ба
нэгдлийн байдалтайгаар
тохиолдоно.
Алмаз, бал чулуу, карбин, фуллерен
байдлаар дангаар тохиолдоно.
Чулуун нүүрс, хүрэн нүүрс зэрэг
нэгдлийн байдлаар оршино.
Мөн нүүрсхүчлийн
хий, карбонатуудын байдлаар
оршино.
- 8.
Агааргүй орчинд мод,чулуун
нүүрсийг халааж модны нүүрс,
идэвхижүүлсэн нүүрс, кокс
байдлаар гарган авна.
Хамгийн цэвэр нүүрс болох
хөөг (С) метаны крекингээр
гаргана.
СН₄=C+2H₂
- 9.
- 10.
- 11.
Хүчилтөрөгч бага орчинд СО
үүснэ.
2С+О₂₌2СО↑
Хүчилтөрөгч хангалттай байхад
СО₂ үүснэ.
С+О₂₌СО₂
Өндөр температурт
металлуудтай харилцан
үйлчлэлцэж карбидуудыг
үүсгэнэ.
Са+2С₌СаС₂
- 12.
Цахилгаан нумын температурт С
устөрөгчтэй нэгдэнэ.
С+2Н₂₌СН₄
Ниймэл бодисуудтай харилцан
үйлчлэлцэнэ.
С+Н₂О₌СО+Н₂↑
Энэ хольц хий 1200⁰С-аас дээш
температурт үүсэх ба хийн түлш
бэлтгэхэд хэрэглэнэ.
С+2Н₂О₌СО₂+2Н₂↑
- 13.
Өндөр температуртС
металлуудын оксидуудаас
металлыг ангижруулдаг.
CuO+C=CO+Cu
Халаасны дараа концентрацтай
азотын ба хүхрийн хүчил С-ийг
давхар оксид болтол нь
исэлдүүлнэ.
C+2H₂SO₄=CO₂↑+2SO₂↑+2H₂O
3C+4HNO₃=3CO₂+4NO+ 2H₂O
- 14.
Энэ нь өнгөгүй, тунгалаг, гэрлийн
цацрагийг хугалах чадвартай, талст
бодис юм. Алмазын дотор
нүүрстөрөгчийн атомууд sp³-эрлийзжсэн
өөр хоорондоо ковалентын холбоогоор
холбогдон тетраэдр торыг үүсгэн
оршино. Алмаз бүх дан бодисуудаас
хамгийн хатуу нь юм. Шил зүсэх, гоѐл
чимэглэл, уулын чулуулгийг өрөмдөхөд
хэрэглэнэ. Дулааныг муу
дамжуулдаг, цахилгааныг
дамжуулдаггүй.
- 15.
Энэ нь хар саарал
өнгөтэй, тунгалаг, металл шиг
өнгөлөг, цахилгаан гүйдлийг сайн
дамжуулдаг бодис юм. Талст бүтэц нь
хязгааргүй параллель 6-н өнцөгт цагираг
үеүдээс тогтсон. Нүүрстөрөгчийн
атомуудад sp²-эрлийзлэлтэнд орсон
байдаг. Үелсэн бүтэцтэй ба үеүдийн
хоорондох зай нь их, холбоонууд нь бат
бэх учраас зөөлөн. Харандаа
үйлдвэрлэх, бал чулуун электродыг
үйлдвэрлэхэд ашиглана.
- 16.
60-аад оны үед нүүрстөрөгчийн
шинэ дүрс хувирал болох карбиныг
нийлэгжүүлжээ. Нүүрстөрөгчийн
атомууд өөр хоорондоо дан ба
гурвалсан холбоогоор холбогдсон
байдаг.
Sp-эрлийзжилттэй-шугаман
бүтэцтэй, хар өнгөтэй нунтаг бодис.
Резин, хар бэх хэвлэлийн бэх
үйлдвэрлэхэд хэрэглэнэ.
- 17.
С₆₀,
С₇₀ бүхий бөмбөлөг
хэлбэрийн молекул юм.
Нүүрстөрөгчийн атом нь 5 ба
6 өнцөгтөөс тогтоно. 6
өнцөгт нь С₆₀-тай молекул
20, С₇₀-тай молекулд 30
байдаг. Органик уусгагчдад
уусдаг. Бал чулууг агаарт
ууршуулхад үүснэ.
- 18.
СО₂-ыгсахар гаргах,гал
унтраах, жимсний ундаа
үйлдвэрлэхэд хуурай мөс гаргах,
сод гарган авах, түүнийг шил
угаагч бодис эм бэлтгэхэд
хэрэглэнэ.
- 19.
Хүнийбие махбододС
агуулгаараа 21,15% байдаг
макроэлемент юм. Энэ нь
бүх эс ба эдийн
найрлаганд уураг, нүүрсус,
витамин, гормоны
хэлбэрээр оршино.