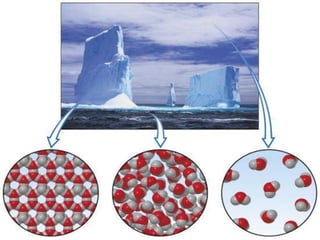
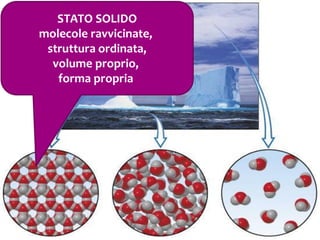
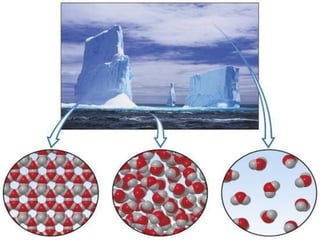
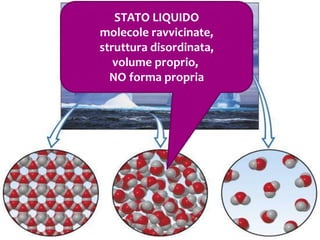
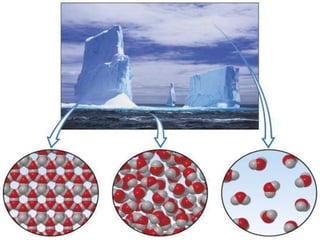
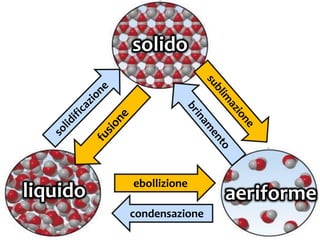
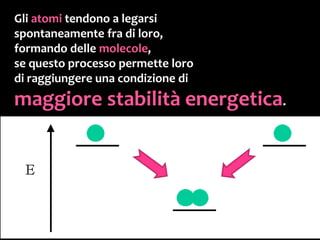
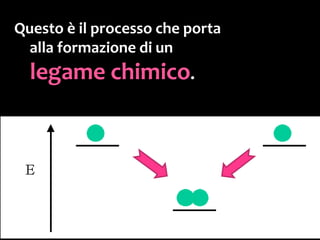
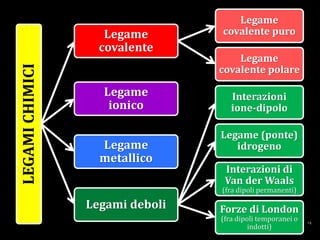
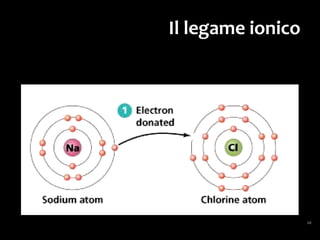
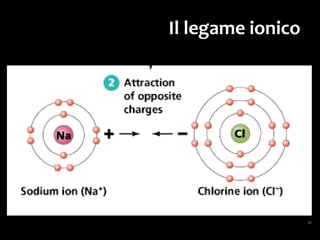
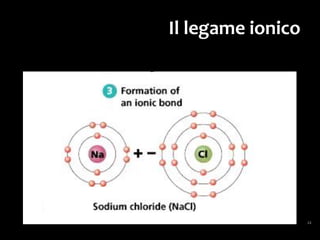
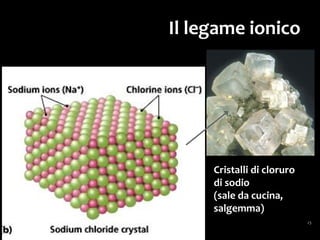
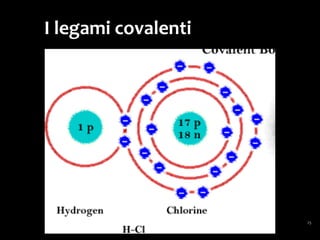
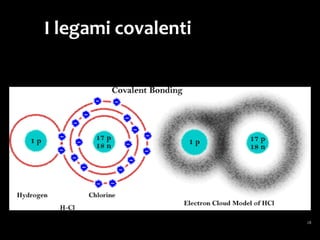
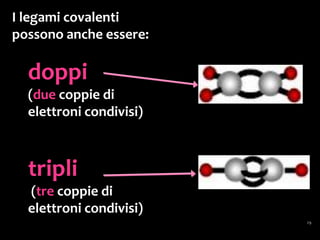
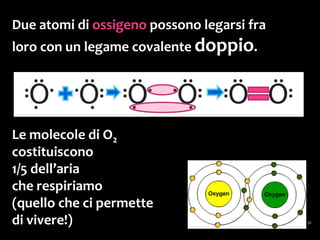
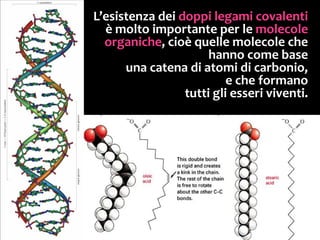
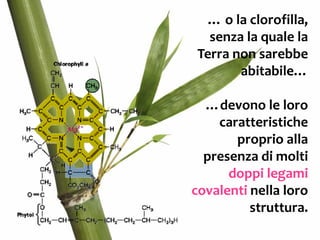
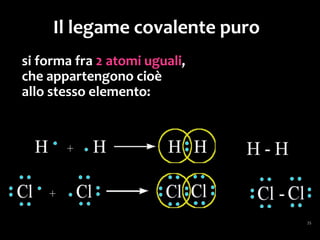
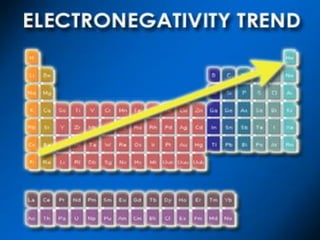
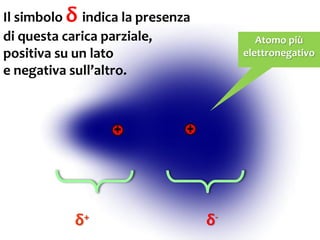
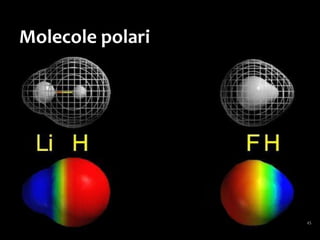
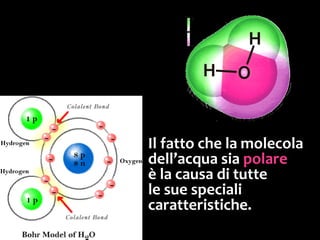
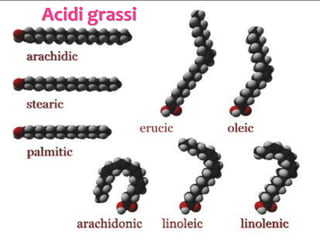
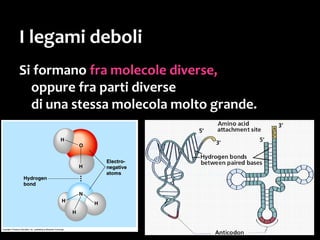
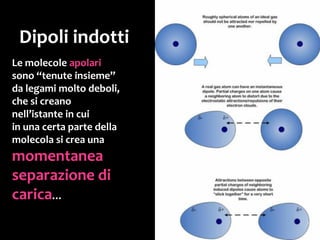
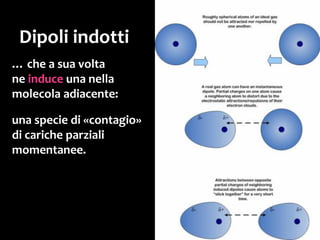
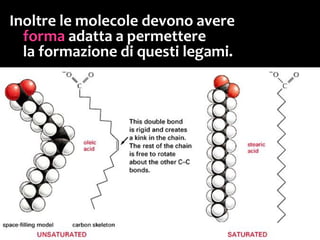
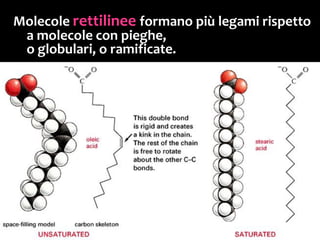
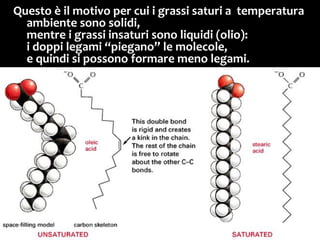
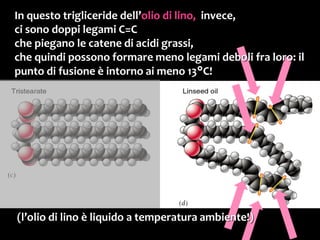
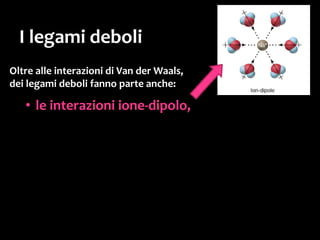
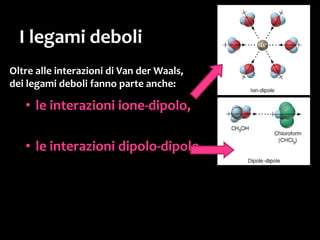
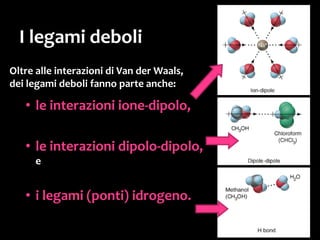
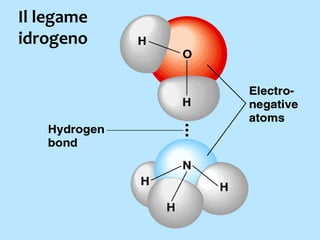
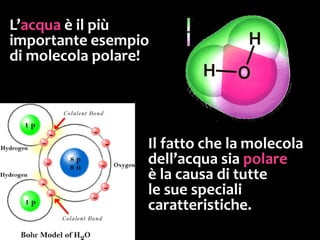
Il documento discute i vari stati della materia e la formazione di molecole attraverso legami chimici, tra cui legami covalenti, ionici e deboli. Viene evidenziato il ruolo delle molecole polari, come l'acqua, e la loro importanza per le caratteristiche chimiche dei viventi. Inoltre, si approfondiscono le differenze tra molecole polari e apolari, e il loro comportamento in presenza di legami deboli.