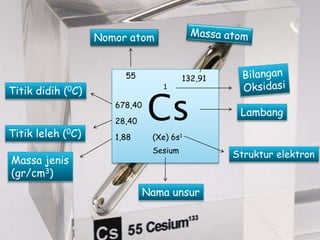
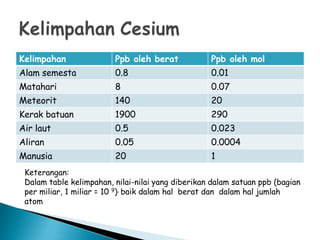
Cesium adalah unsur logam alkali dengan nomor atom 55 yang ditemukan oleh Robert Bunsen dan Gustav Kirchhoff pada tahun 1860. Unsur ini sangat reaktif, memiliki daya oksidasi besar, dan digunakan dalam berbagai aplikasi, termasuk teknologi waktu dan reagen kimia. Meskipun jarang ditemui, senyawa cesium dapat beracun dalam jumlah besar jika terpapar.