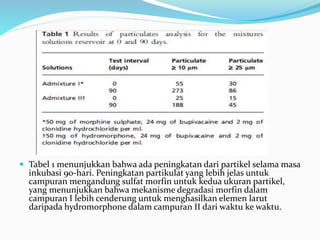
Penelitian ini mengevaluasi stabilitas dan kompatibilitas campuran morfin sulfat, bupivakain hidroklorida, dan clonidine hidroklorida dalam pompa aliran implan konstan. Hasilnya menunjukkan bahwa campuran ini stabil pada suhu tubuh selama 90 hari, dengan konsentrasi obat yang tidak menyimpang lebih dari 2% dari konsentrasi awal. Temuan ini mendukung penggunaan campuran obat tersebut dalam sistem infus intratekal jangka panjang.