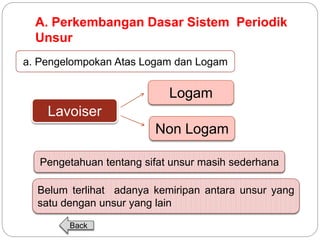
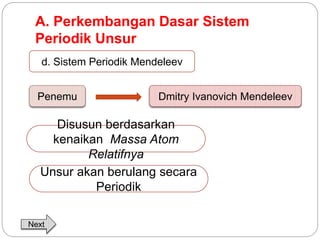
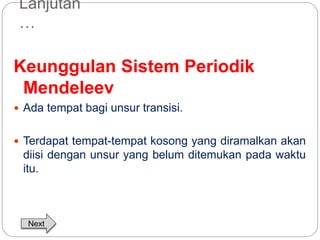
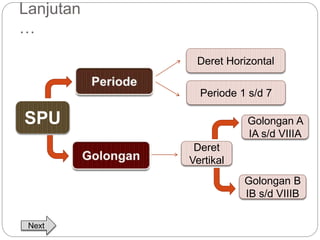
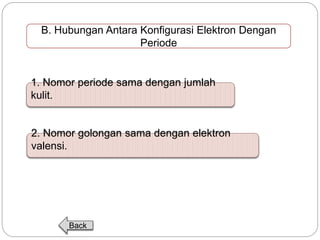
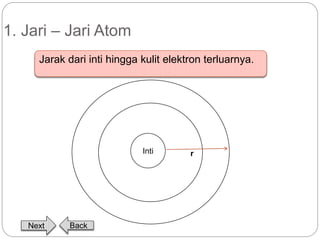
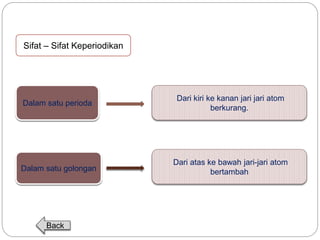
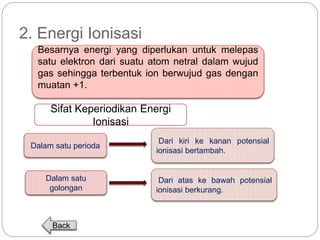
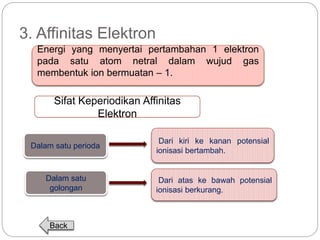
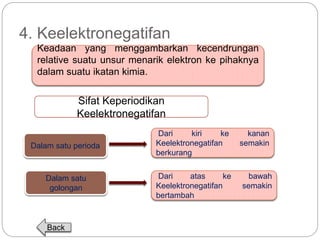
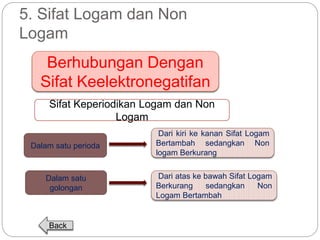
Dokumen ini menjelaskan sistem periodik unsur, mencakup perkembangan, pengelompokan, dan sifat-sifat periodik unsur berdasarkan teori atom. Terdapat penjelasan mengenai sistem periodik yang dikembangkan oleh Dmitry Mendeleev dan sistem modern yang berdasarkan nomor atom. Materi ini termasuk latihan dan indikator untuk memahami struktur atom, ikatan kimia, dan klasifikasi unsur.