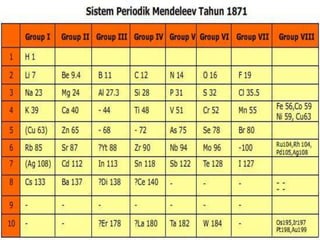
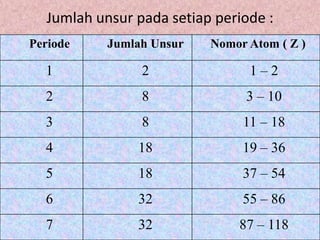
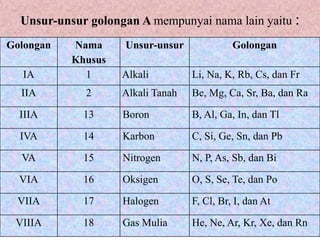
Dokumen ini membahas perkembangan sistem periodik unsur dimulai dari hukum oktaf Newlands, diikuti oleh sistem Mendeleev yang menekankan pengelompokan unsur berdasarkan massa atom, serta kelebihan dan kelemahannya. Selanjutnya, sistem periodik modern dikemukakan oleh Moseley, yang lebih memfokuskan pada nomor atom sebagai dasar pengelompokkan unsur, menciptakan tabel yang terdiri dari periode dan golongan yang teratur. Selain itu, dokumen ini menjelaskan sifat periodik unsur, termasuk jari-jari atom, afinitas elektron, energi ionisasi, dan keelektronegatifan yang berubah sesuai dengan posisi unsur dalam tabel periodik.