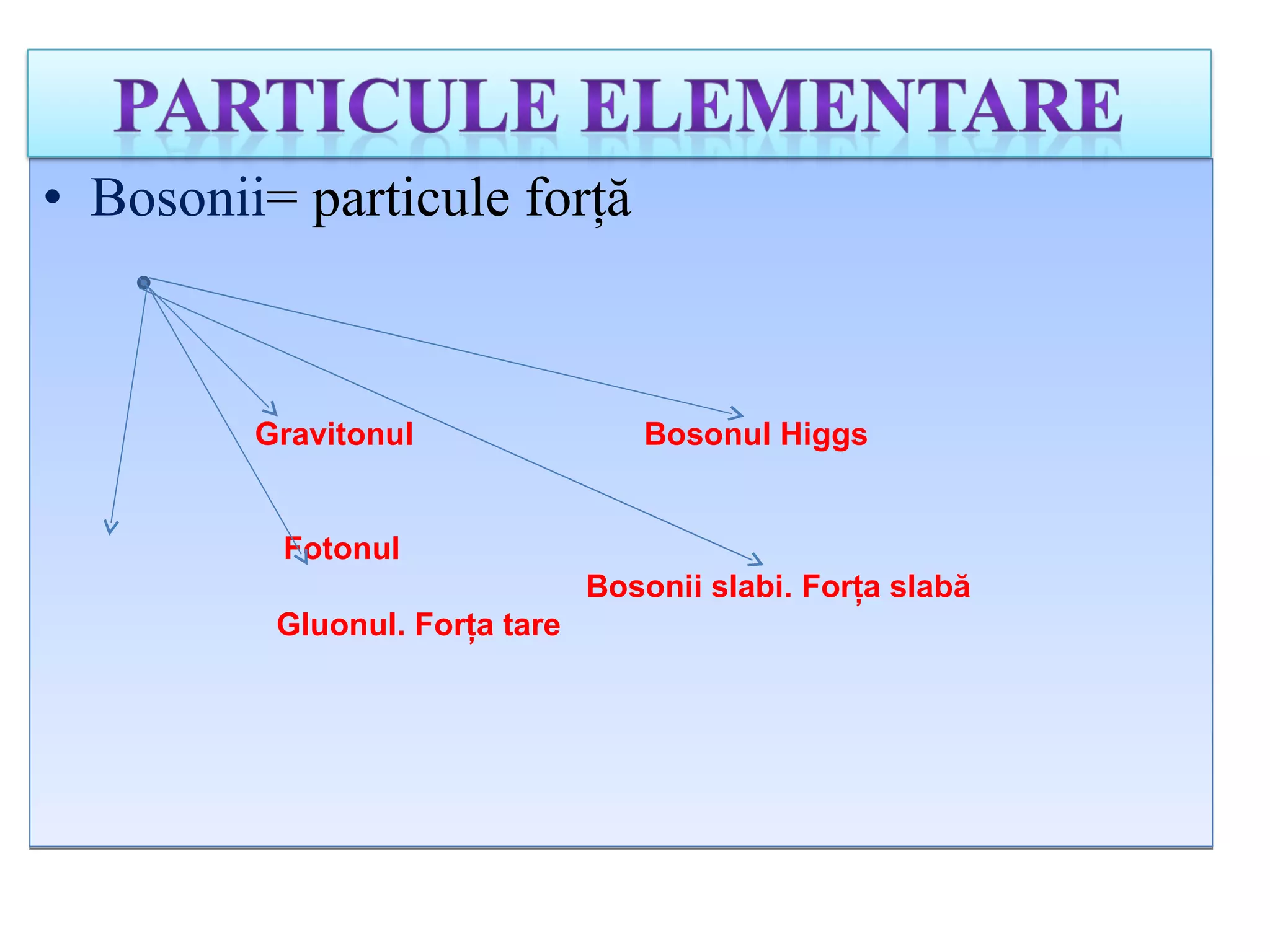
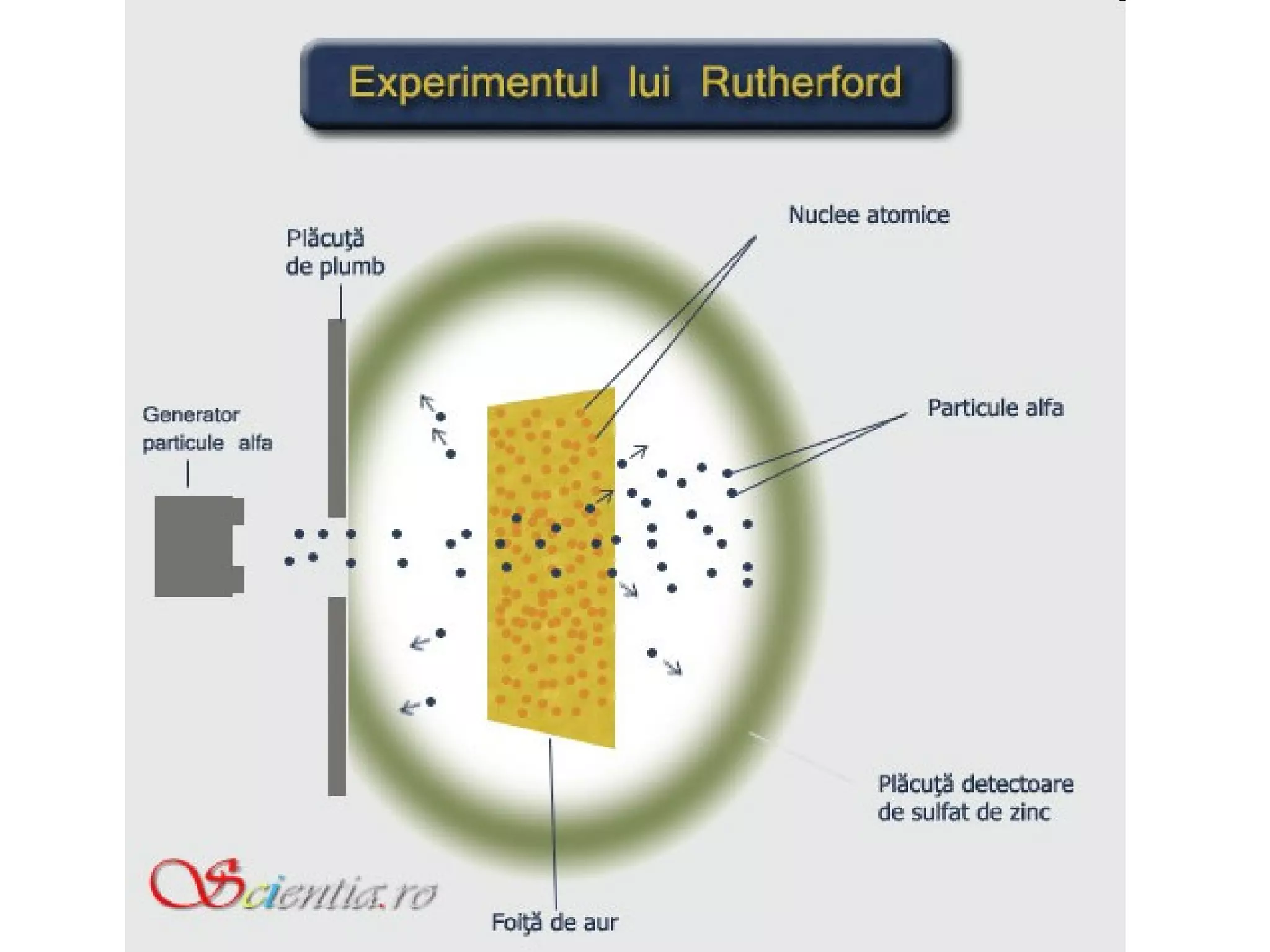
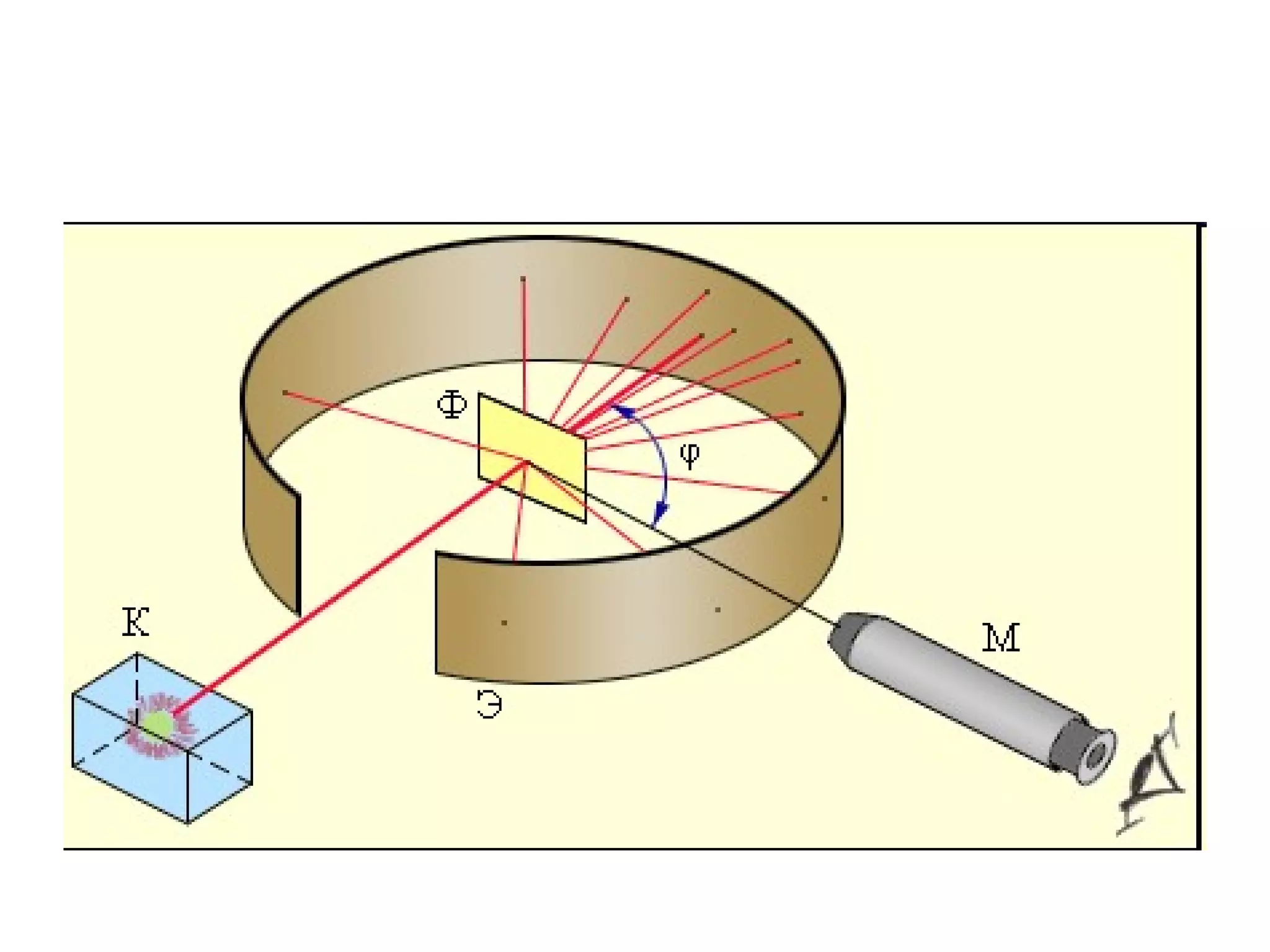
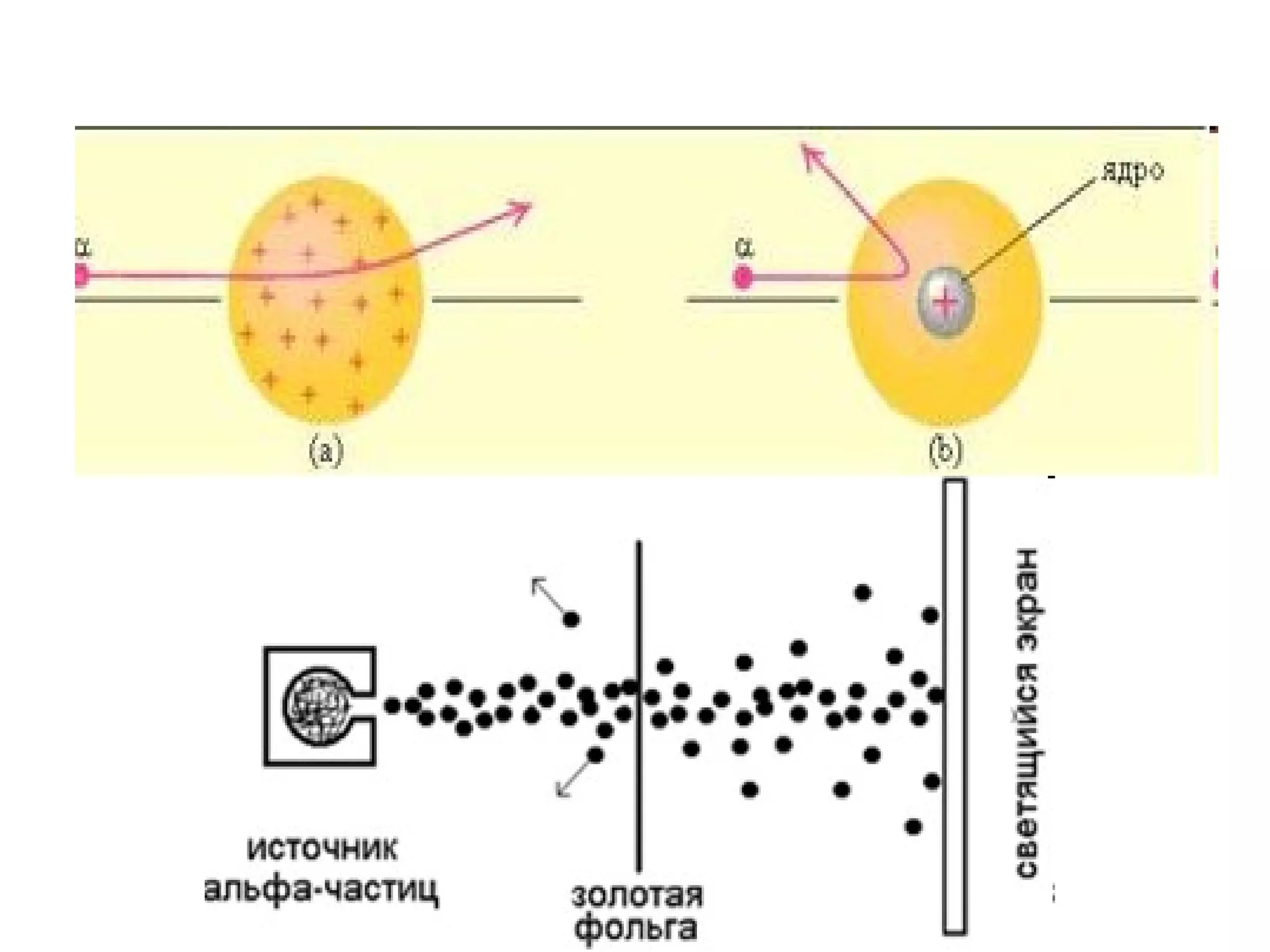
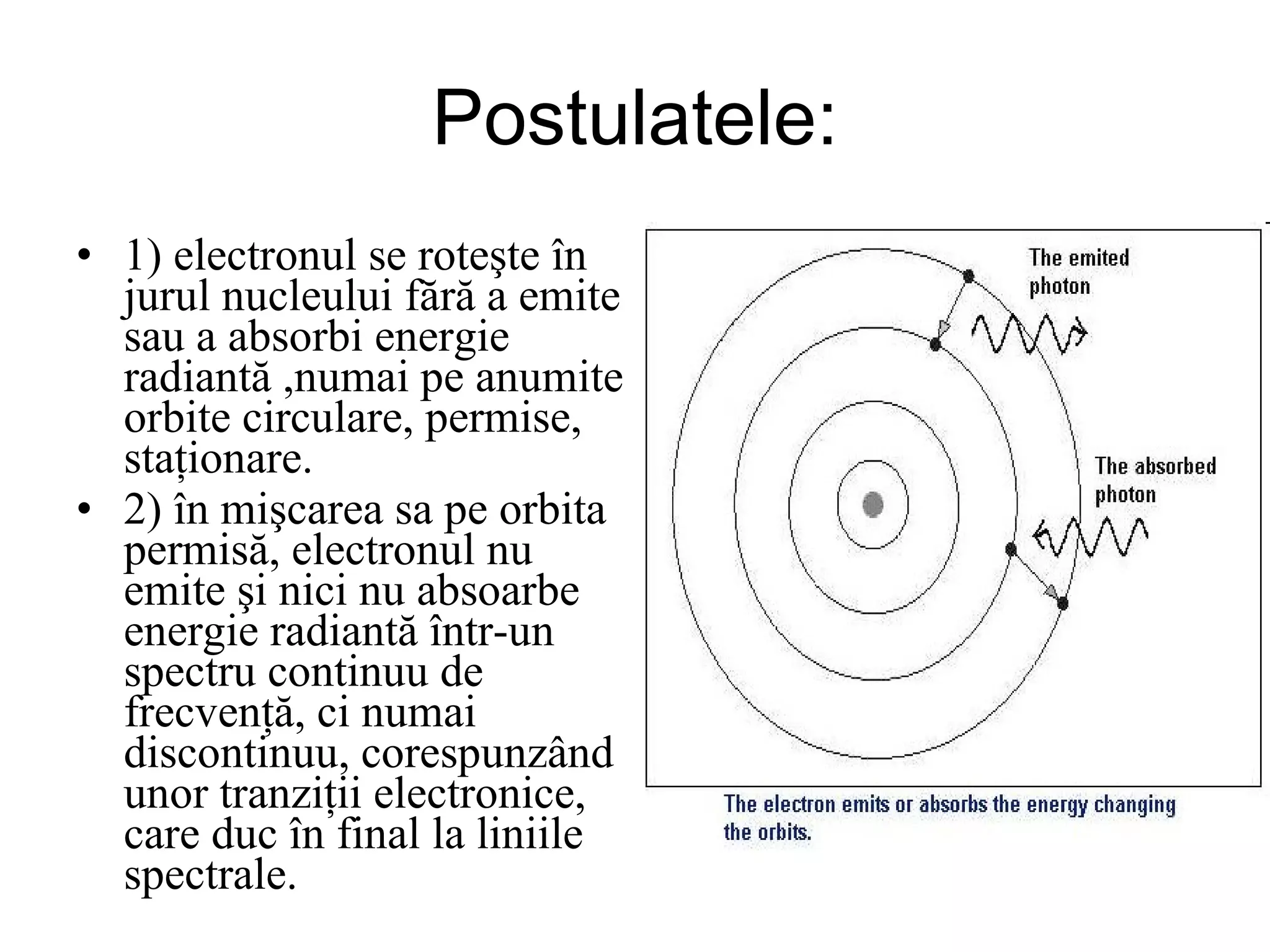
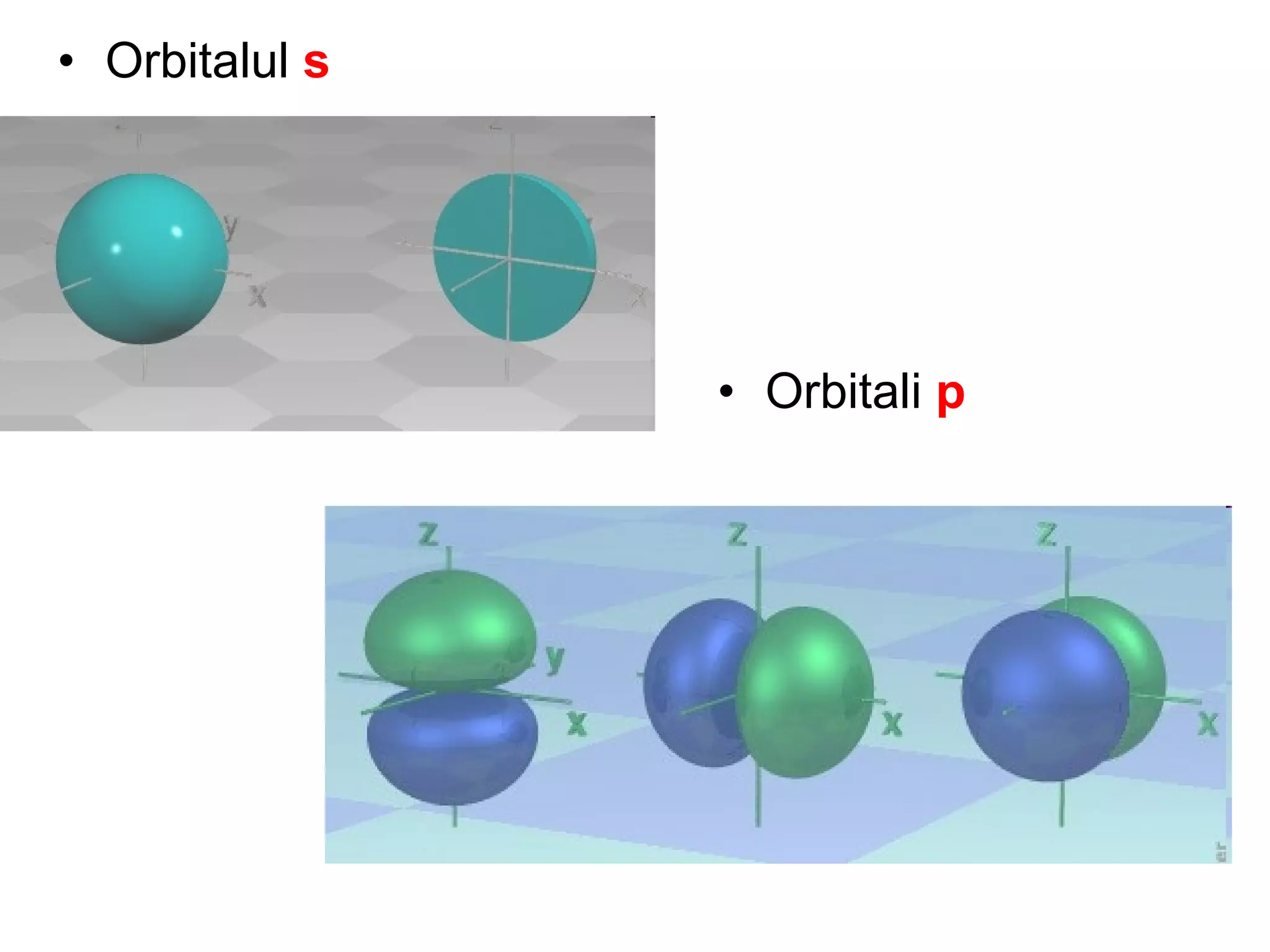
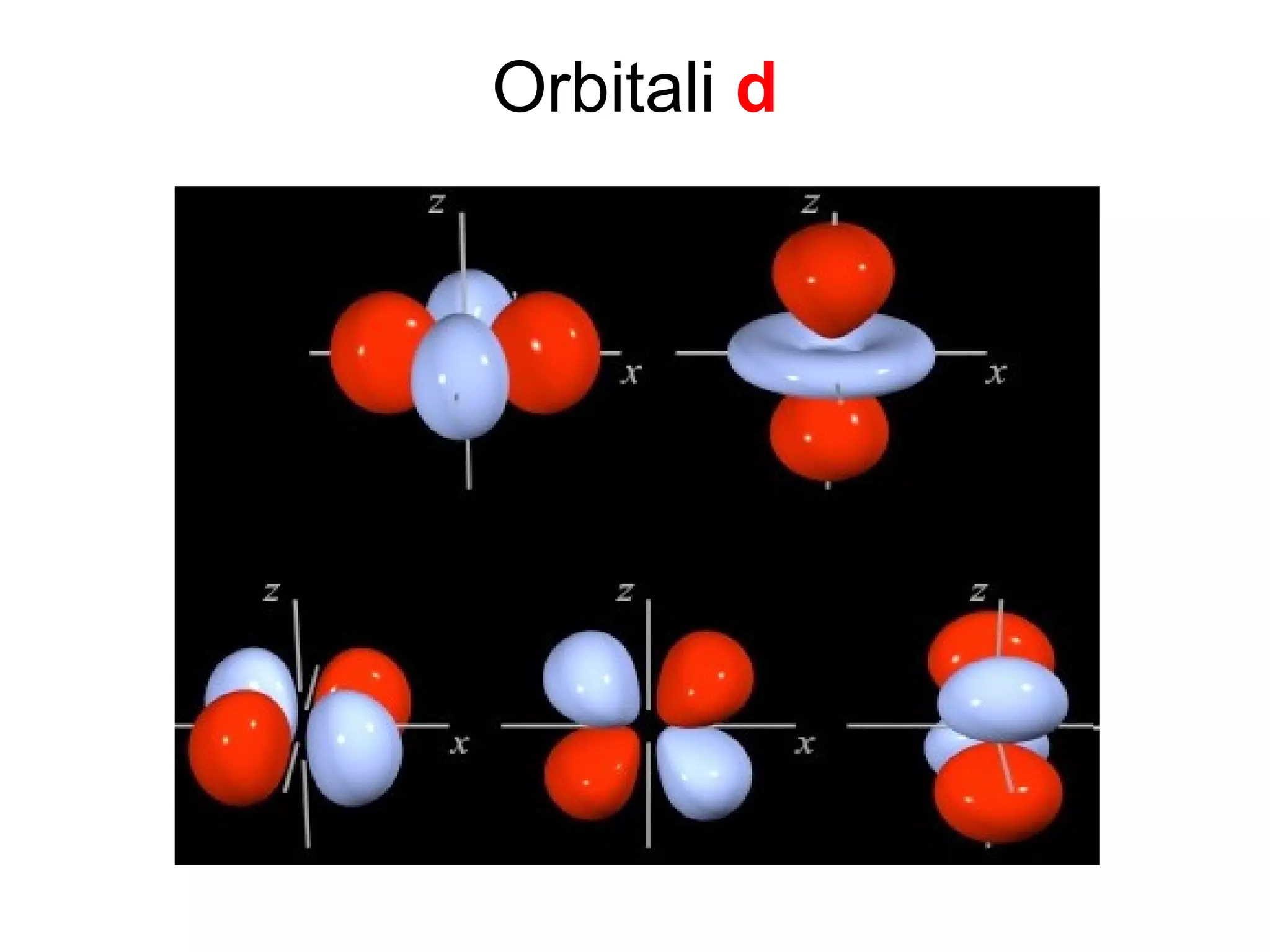
Atomul este cea mai mică particulă ce păstrează proprietățile chimice ale unui element, compus din nucleu și înveliş electronic. Modelele atomice, de la cel sferic la cel cuantic, au evoluat pentru a descrie structura și comportamentul atomilor, incluzând conceptele de protoni, neutroni și electroni. Izotopii diferă prin numărul de neutroni, iar bosonii și fermionii sunt categorii de particule subatomice cu diferite proprietăți.