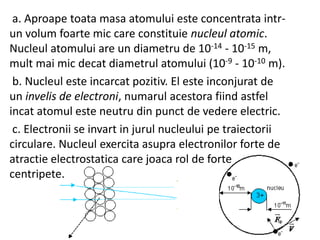
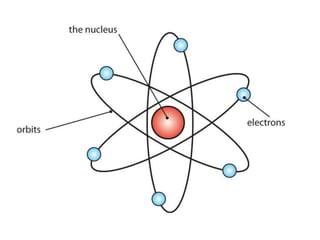
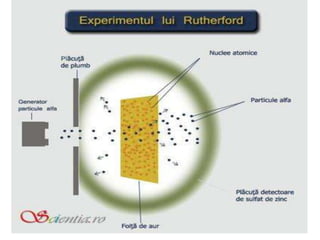
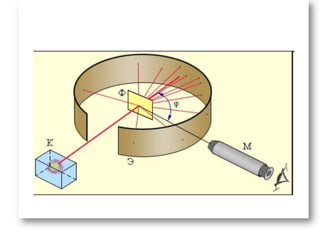
Descoperirea radioactivității de către Becquerel a dus la abandonarea ideii de indivizibilitate a atomilor, permițând dezvoltarea unor modele atomice. Modelul atomic al lui Rutherford a arătat că nucleul atomic este concentrat într-un spațiu mic și încărcat pozitiv, electronii fiind învârtiți în jurul său, pe orbite circulare. Modelul lui Bohr a completat acest concept prin introducerea orbitelor stationare, stabilind că electronii pot emite sau absorbi energie doar prin tranziții între aceste orbite.