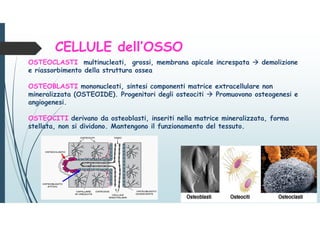
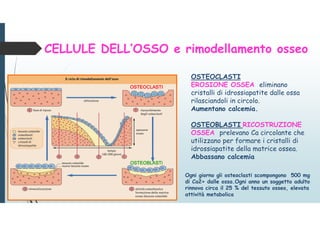
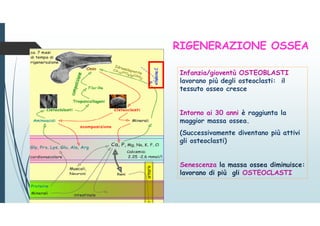
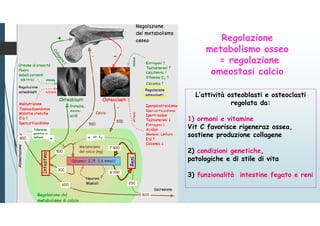
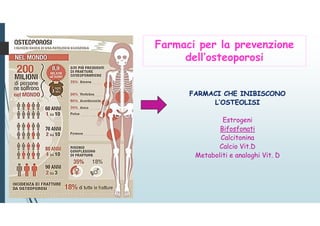
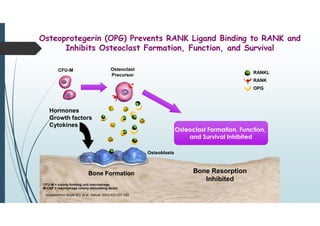
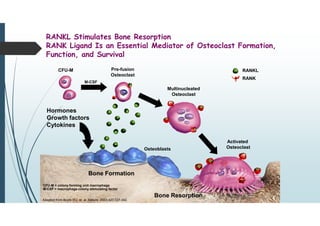
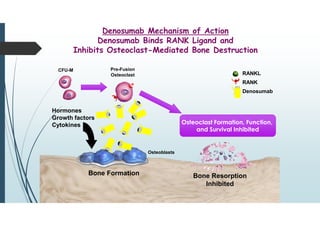
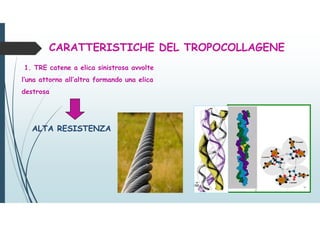
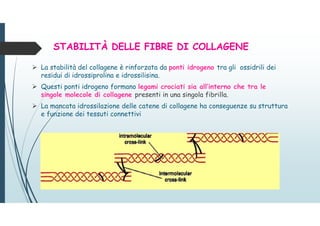
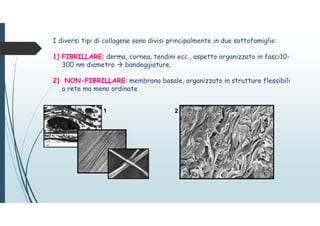
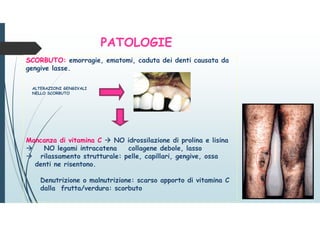
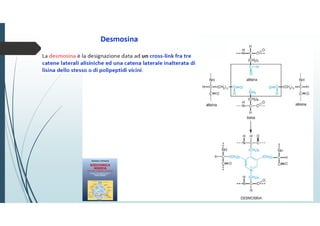
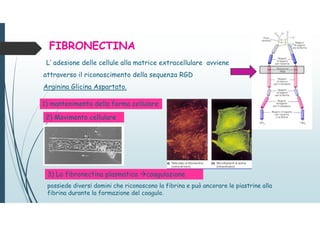
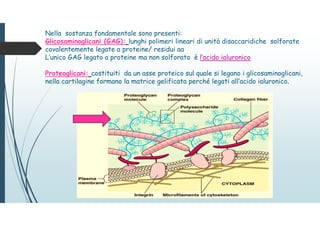
Il documento discute le proteine della matrice extracellulare (MEC), evidenziando la loro struttura e funzione nei tessuti connettivi. Sottolinea l'importanza della sintesi e degradazione delle componenti della MEC, come collagene ed elastina, e le patologie associate come l'osteogenesi imperfetta e lo scorbuto. Viene anche trattato il ruolo delle proteine adesive e dei recettori nel mantenere l'integrità della MEC e nella comunicazione cellulare.










































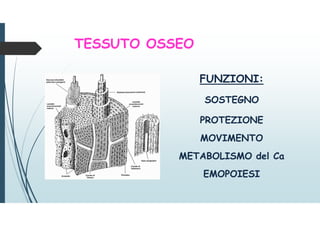
![OSSO
Principale riserva di Ca2+ corporeo: scheletro = 99% Ca2+
Composizione:
23% MINERALI resistenza trazione e carico Ca++ immagazzinato come
CRISTALLI DI IDROSSIAPATITE Ca10 (PO4)6 (OH)2
77% PROTEINE forma e struttura principale COLLAGENE (tipo I).
Osso 1,1 Kg < [Ca2+] > 1,5 Kg
Plasma [Ca2+] = 2 mM
pochi mg di Ca2+ dall’osso sono sufficienti per variare molto calcemia, senza
recare danno allo scheletro.](https://image.slidesharecdn.com/medlez38meccollageneect-191218101559/85/Med-lez-38-mec-collagene-ect-54-320.jpg)

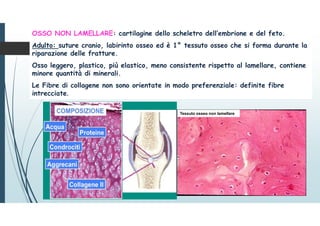
![TESSUTO CONNETTIVO DENSO, contenente vasi sanguigni, vasi linfatici e fasci
nervosi -> approvvigionamento, smaltimento, informazione.
STRUTTURA E
COMPOSIZIONE
PORZIONE MINERALIZZATAimpalcatura fibrosa
proteica costituita da collagene di tipo I
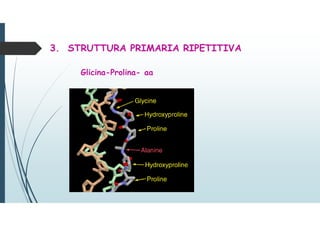
aa prevalenti: Glicina, Prolina, Lisina, Glutammato,
Alanina e Arginina (Osteoblasti)
Strati minerali (fibre ricoperte da idrossiapatite
[Ca10(PO4)6(OH)2]: 60% Ca, 30% P e 10% O2 e H2
Minerale (presente anche libero in natura).](https://image.slidesharecdn.com/medlez38meccollageneect-191218101559/85/Med-lez-38-mec-collagene-ect-57-320.jpg)