1. Dokumen tersebut membahas tentang konsep kemolaran, laju reaksi, dan faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, suhu, luas permukaan, dan katalis.
2. Laju reaksi dipengaruhi oleh konsentrasi, suhu, luas permukaan, dan keberadaan katalis. Semakin besar faktor-faktor tersebut maka semakin cepat laju reaksi.
3. Katalis dapat mempercepat la




![Konsep Laju Reaksi
Berkurangnya konsentrasi pereaksi
persatuan waktu atau bertambahnya
konsentrasi hasil reaksi persatuan waktu.
Δ[ ]
Δt
Δ[ ]
Δt
V
pereaksi hasil reaksi
](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-6-320.jpg)
![Secara umum untuk reaksi:
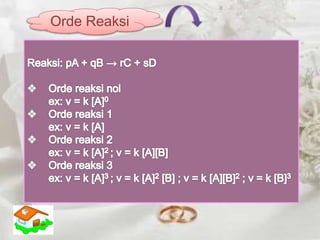
pA + qB r C + s D
V = k[A]x [B]y
Ket :
v = laju reaksi (Ms-1)
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
k = konstanta laju reaksi
x = orde reaksi zat A
y = orde reaksi zat B](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-7-320.jpg)


![Konsentrasi semakin
besar [], semakin cepat
laju reaksi.
Semakin kecil [],
semakin lambat laju
reaksi.](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-12-320.jpg)
![Untuk reaksi
A + B C
Rumusan laju reaksi adalah :
V =k.[A]m.[B]n
Dimana :
k = tetapan laju reaksi
m = orde reaksi untuk A
n = orde reaksi untuk B
Orde reakasi total = m + n](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-13-320.jpg)
![Rumusan laju reaksi tersebut diperoleh dari percobaan.
Misalkan diperoleh data percobaan untuk reaksi :
NO+ Cl NOCl(g) 2(g)
2(g)
Diperoleh data sebagai berikut :
Perc [NO] M [Cl2] M V M/s
1
0,1
0,1
4
2
0,1
0,2
16
3
0,2
0,1
8
4
0,3
0,3
?](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-14-320.jpg)
![Konsentrasi
Rumusan laju reaksi untuk reaksi tersebut adalah :
V = k.[NO]m.[Cl2]n
Orde NO = m Orde Cl2 = n
Percobaan 1 dan 3 Percobaan 1 dan 2
NO V
[ ]
NO
[ ]
3
[ ]
0,2
2
2
1
8
4
0,1
V
3
1
1
m
V
NO
m
m
m
m
Cl V
[ ]
2
Cl
[ ]
2 2
[ ]
0,2
2
4
2
16
4
0,1
V
2
1
2 1
n
V
Cl
n
n
n
n](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-15-320.jpg)
![Maka rumusan laju reaksinya adalah :
V=k.[NO]1.[Cl2]2
Harga k diperoleh dengan memasukan salah satu
data percobaan
V
NO Cl
[ ].[ ]
2
2
2
4
0,1.0,1
3 2 1
4.10
k
k
k M s
Konsentrasi](https://image.slidesharecdn.com/lajureaksi-141123232008-conversion-gate02/85/Laju-reaksi-16-320.jpg)











