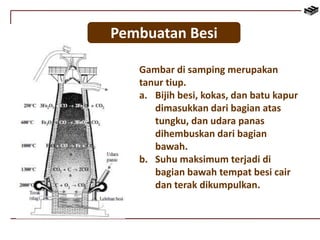
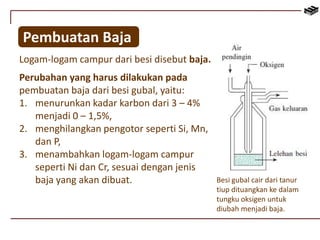
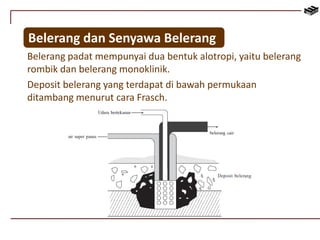
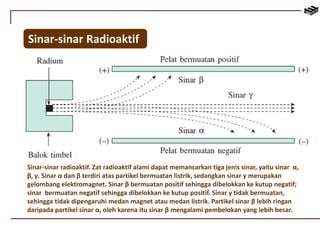
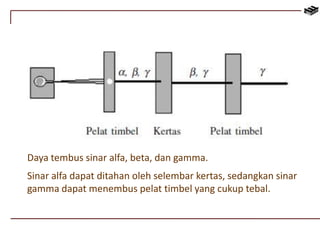
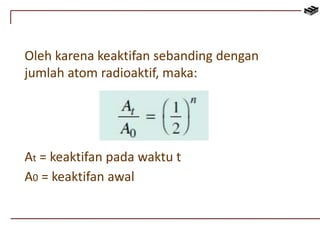
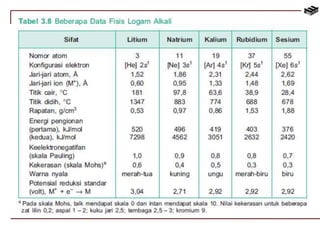
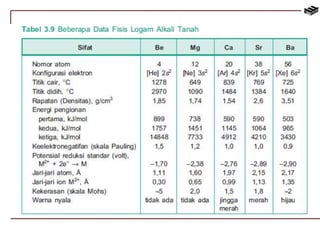
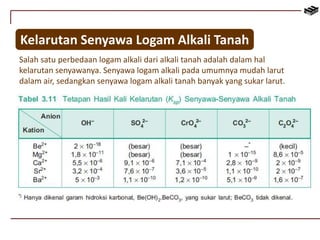
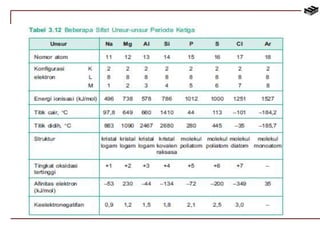
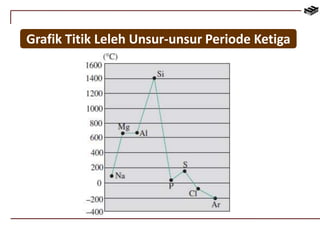
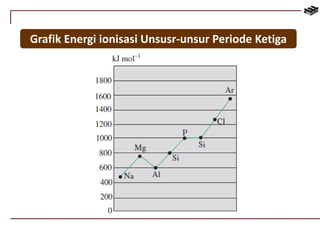
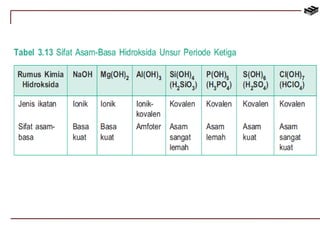
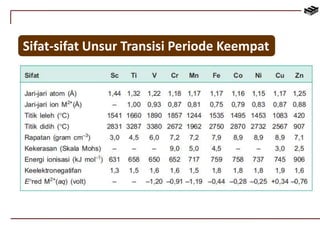
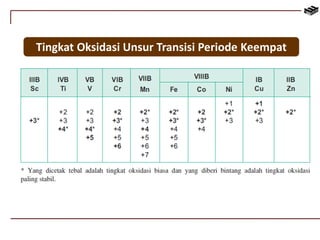
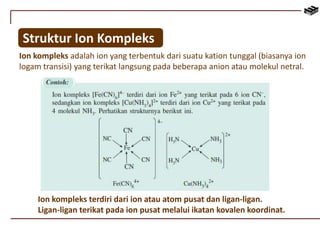
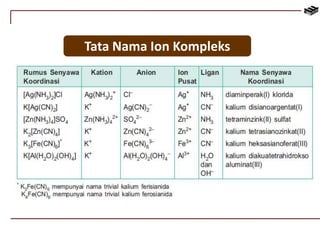
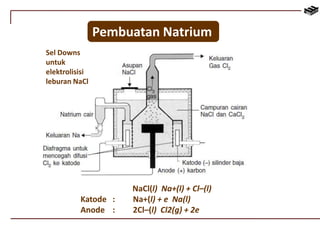
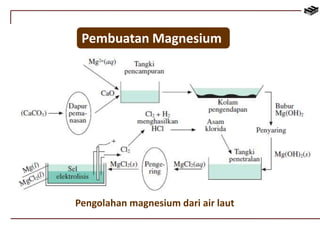
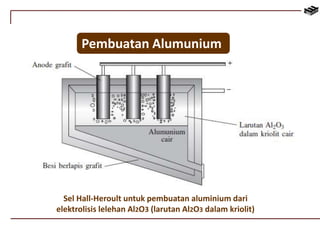
Dokumen ini membahas berbagai aspek kimia unsur, termasuk kelimpahan, sifat, pembuatan, dan penggunaan unsur logam serta nonlogam. Terdapat penjelasan mengenai sifat halogen, logam alkali, logam alkali tanah, unsur transisi, dan aplikasi praktis dari beberapa unsur seperti natrium, magnesium, dan aluminium. Selain itu, dokumen mencakup pembuatan dan penggunaan baja dan tembaga dalam industri.


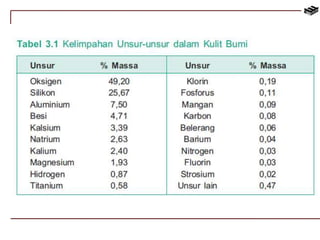
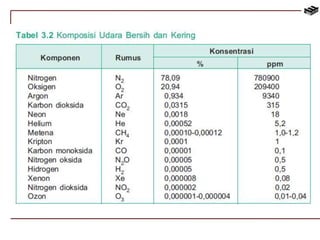






























![Penggunaan Aluminium Sulfat
[Al2(SO4)3]
Aluminium sulfat digunakan pada
pengolahan air minum, yaitu untuk
mempercepat koagulasi lumpur
koloidal.](https://image.slidesharecdn.com/bab3kimiaunsur-141113103549-conversion-gate02/85/Bab-3-kimia-unsur-53-320.jpg)