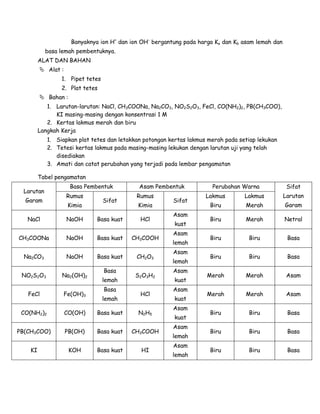
Laporan akhir praktikum kimia ini disusun untuk menunjukkan hasil percobaan tentang hidrolisis garam dan sifat larutannya. Hasil eksperimen menunjukkan bahwa garam dengan asam kuat dan basa kuat bersifat netral, sementara kombinasi asam lemah dan basa kuat menghasilkan sifat basa, dan sebaliknya, asam kuat dengan basa lemah menghasilkan sifat asam. Penulis berharap laporan ini dapat bermanfaat meskipun menyadari adanya kesalahan dan mengharapkan kritik yang membangun.