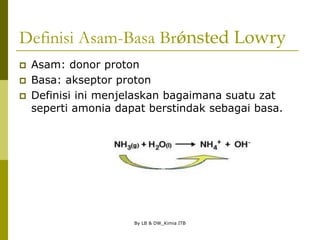
Dokumen tersebut membahas tentang definisi asam-basa menurut Arrhenius, Brønsted-Lowry, serta beberapa konsep kimia yang terkait seperti pH, pKa, tetapan kesetimbangan, dan efek ion senama. Secara khusus dijelaskan tentang perbedaan definisi asam-basa menurut Arrhenius dan Brønsted-Lowry beserta contohnya.








![By LB & DW_Kimia ITB
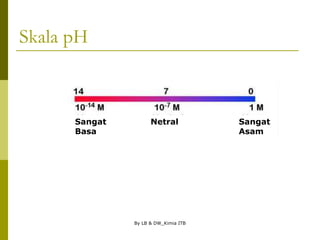
Autoionisasi Air
Autoionisasi: ketika molekul air bereaksi satu sama lain
membentuk ion-ionnya, dengan catatan bahwa [H2O]
adalah tetap dan telah tercakup dalam Kw
.
Hasil Kali
kelarutan air
-14 o
= 1,0 x 10 pada 25 C](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-10-320.jpg)


![By LB & DW_Kimia ITB
Perhitungan pH dan pOH
Tentukan nilai pH dari [H+] = 6,7 x 10-3 M;
Jawab: pH = - log [H+] = 2,2
Tentukan nilai pH dari [H+] = 5,2 x 10-12 M;
Jawab: pH = 11,3
Tentukan [H+] jika pH = 4,5.
Jawab: [H+] = 3,2 x 10-5 M
Tentukan pOH dari 1,7 x 10-4 M NaOH
Jawab: pOH= 3,8; pH = 10,2
Tentukan pOH dari 5,2 x 10-12 M H+
Jawab: pH = 11,3 ; pOH = 2,7
Tentukan [OH-] jika pH = 4,5
Jawab: pOH = 9,5, jadi [OH-] = 3,2 x 10-10 M](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-13-320.jpg)




![By LB & DW_Kimia ITB
Kesetimbangan Asam Lemah
Diasumsikan [Bz-] diabaikan terhadap [HBz]. Adanya
kontribusi H3O+ dari air pun diabaikan.
2
-5
-5
a
K
0,10
x = 6,28 x 10 0,10
= 0,0025 M
pH = 2,60
6,28 x 10
x
HBz H3O+ Bz-
Kons. Awal, M 0,10 0,00 0,00
Perubahan, DM x x x
Kons. Setimbang, M 0,10 – x x x
[H3O+] = [Bz-] = x](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-19-320.jpg)











![By LB & DW_Kimia ITB
Efek Ion Senama
Jika asumsi x bisa diabaikan terhadap 0,099 dan 0,997,
maka persamaan bisa disederhanakan sebagai berikut:
Catatan: ketika suatu larutan mengandung konsentrasi asam
lemah sama dengan konsentrasi basa konjugasinya, maka
[H+] = Ka
5
5
1,7 10 0,099
0,097
1,7 10
x
x
x x H
](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-31-320.jpg)



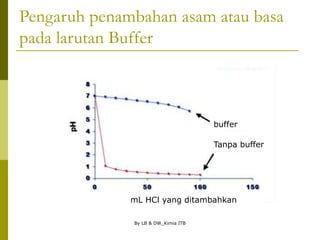
![By LB & DW_Kimia ITB
Pengaruh penambahan asam atau basa
pada larutan Buffer
Mula-mula untuk sampel air murni pada pH 7.
Setelah penambahan 10 mL larutan HCl 1,0 M:
[H3O+] = (10 mL)(1,0 M)/(110 mL) = 0,091
pH = 1,04.
Perhatikan bahwa terjadi perubahan pH yang
sangat besar!](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-35-320.jpg)









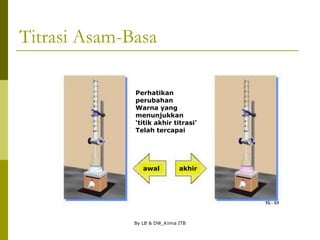
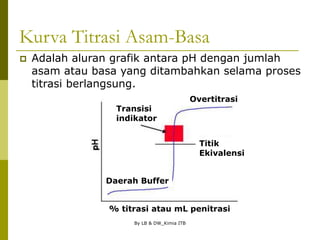
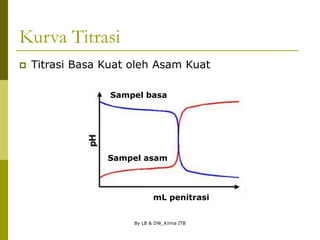
![By LB & DW_Kimia ITB
Kurva Titrasi
Asam kuat dititrasi oleh basa kuat: 100 mL larutan HCl
0,1 M dititrasi oleh larutan NaOH 0,1 M, diperoleh data:
mL
penitrasi
Total mL [H3O+] pH
0 100 0,100 1,00
10 110 0,082 1,09
20 120 0,067 1,17
30 130 0,054 1,28
40 140 0,043 1,37
50 150 0,033 1,48
60 160 0,025 1,60
70 170 0,018 1,74
80 180 0,011 1,96
90 190 0,0053 2,28](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-48-320.jpg)
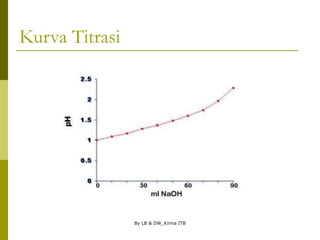
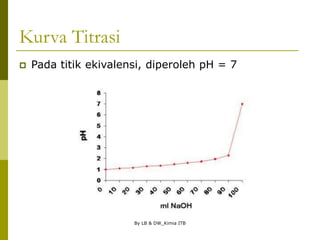
![By LB & DW_Kimia ITB
Kurva Titrasi
Overtitrasi, yaitu kelebihan penitrasi yang harus
diperhitungkan.
10 mL
[ ] 0,10 M x
210 mL
= 0,0048 M
pOH = 2,32
pH = 14,00 - 2,32 = 11,68
OH
](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-51-320.jpg)
![By LB & DW_Kimia ITB
Kurva Titrasi
mL penitrasi Total mL [OH-] pH
110 210 0,0048 11,68
120 220 0,0091 11,96
130 230 0,013 12,11
140 240 0,017 12,23
150 250 0,020 12,30
160 260 0,023 12,36
170 270 0,026 12,41
180 280 0,029 12,46
190 290 0,031 12,49
200 300 0,033 12,52](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-52-320.jpg)
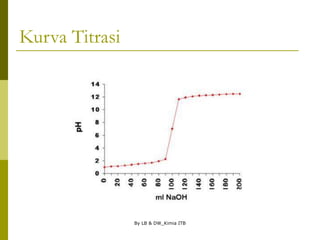
![By LB & DW_Kimia ITB
Titrasi asam dan basa lemah
Titrasi 0%:
Jika sampelnya asam lemah, gunakan persamaan
berikut untuk menghitung pH, karena [H3O+] = [A-].
Jika sampelnya asam lemah, gunakan persamaan
berikut untuk menghitung pH, karena [OH-] = [HA].](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-56-320.jpg)


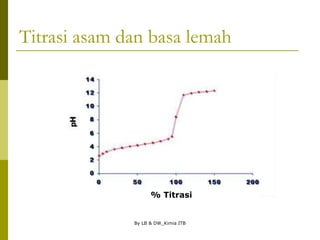

![By LB & DW_Kimia ITB
Tetapan kesetimbangan Bertahap
Untk H3PO4, terdapat 3 nilai Ka. Tiap [H3O+]
dalam tiap persamaan adalah sama.](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-61-320.jpg)
![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Kelarutan (s), adalah konsentrasi maksimum
zat terlarut yang dapat larut pada sejumlah
tertentu pelarut pada suhu tertentu.
Contoh:
Kelarutan AgCl dalam air adalah 1,3 × 10-5 M.
Kelarutan AgCl dalam larutan NaCl 0,1 M adalah 1,7 ×
10-9 M.
Hasil Kali Kelarutan (Ksp), jika garam AxBy
dilarutkan dalam air, maka hasil kali kelarutan
(Ksp) garam ini didefinisikan sebagai:
AxBy(s) ⇌ xAy
+(aq)+ yBx
-(aq), Ksp =
[Ay
+]x[Bx
+]y
Contoh:
Ag2CO3(s) ⇌ 2Ag+(aq) + CO3
2-(aq), Ksp = [Ag+]2[CO3
2-]](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-62-320.jpg)

![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Pengaruh ion senama
Adanya ion senama dalam larutan garam yang
kelarutannya kecil dalam air akan mempengaruhi
kelarutannya yang mengakibatkan terjadinya
pergeseran kesetimbangan ke arah reaktan, yang berarti
memperkecil kelarutan garam tersebut.
Contoh: Kelarutan AgCl dalam air adalah 1,3 × 10-5 M,
sedangkan kelarutan AgCl dalam larutan NaCl 0,1 M
adalah 1,7 × 10-9 M.
Ini disebabkan adanya penambahan [Cl-] dalam larutan
AgCl, sehingga reaksi bergeser ke kiri (ke arah
pembentukan AgCl(s)).
NaCl(aq) Na+(aq) + Cl-(aq)
AgCl(s) ⇌ Ag+(aq) + Cl-(aq)](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-64-320.jpg)
![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Berapakah kelarutan molar PbI2 dalam 0,1 M larutan KI?
(Ksp PbI2 = 7,1 x 10-9)
Jawab: KI(aq) K+(aq) + I-(aq)
0,1 M 0,1 M 0,1 M
PbI2(s) ⇌ Pb2+(aq) + 2I-(aq)
s s 2s
Ksp PbI2= 7,1 x 10-9 =[Pb2+][I-]2=(s)(0,1+s)2
Jika nilai s dianggap kecil terhadap 0,1 M, maka s dapat
diabaikan, sehingga:
7,1 x 10-9 ≈(s)(0,1)2 = 0,01s
s= 7,1 x 10-7 M
Maka kelarutan PbI2 dalam larutan KI 0,1 M adalah 7,1 x 10-7 M.
Hal ini meunjukkan bahwa kelarutannya lebih kecil daripada
kelarutan PbI2 dalam larutan tanpa adanya KI (kelarutan PbI2
dalam air = 8,4 x 10-4)](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-65-320.jpg)
![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Pengaruh pembentukan kompleks
Adanya penambahan suatu senyawa yang dapat
membentuk senyawa kompleks dengan kation dari
garam yang sulit larut dalam air, dapat meningkatkan
kelarutannya.
Hal ini disebabkan kation tersebut bereaksi dengan
suatu ligan yang membentuk senyawa kompleks
sehingga jumlah kation dalam larutan berkurang, yang
mendorong kesetimbangan bergeser ke arah penguraian
garam menjadi ion-ionnya.
Contoh: senyawa AgBr dalam larutan NH3 akan lebih
mudah larut daripada kelarutannya dalam air.
AgBr(s) + 2NH3 → [Ag(NH3)2]+(aq) + Br-(aq)
Proses ini melibatkan dua reaksi kesetimbangan, yaitu:
AgBr(s) ⇌ Ag+(aq) + Br-(aq), Ksp = 5 × 10-13
[Ag(NH3)2]+(aq) ⇌ Ag+(aq) + 2NH3(aq), K = 6 × 10-8](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-66-320.jpg)
![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Contoh: Tentukan jumlah minimum amoniak
yang diperlukan dalam 1 L air untuk melarutkan
0,01 mol AgBr (Ksp = 5 x 10-13).
Jawab: AgBr(s) ⇌ Ag+(aq) + Br-(aq)
Ksp AgBr = [Ag+][Br-]= 5 x 10-13=[Ag+]x(0,01)
[Ag+] = 5 x 10-11 M, ini adalah ion Ag+ yang
dapat bereaksi dengan NH3 membentuk senyawa
kompleks:
Ag+(aq) + NH3(aq) ⇌ Ag(NH3)2
+
, Kf = 1/K =
1/(6x10-8) = 1,67 x 107](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-67-320.jpg)
![By LB & DW_Kimia ITB
Kelarutan dan Hasil Kali Kelarutan
Jadi, untuk melarutkan AgBr, dibutuhkan sedikitnya
3,46 M NH3 dalam larutan. Karena 0,02 mol NH3
dibutuhkan untuk pembentukan 0,01 mol ion
[Ag(NH3)2]+, maka total NH3 yang dibutuhkan adalah
3,48 M.
3 2
2
3
3 2
7
2
11
3
3
( )
( ) maksimal yang dapat terbentuk
adalah sama dengan [AgBr] = 0,01 M, jadi
0,01
1,67 10
5 10
3,48
f
f
Ag NH
K
Ag NH
Ag NH
K x
x NH
NH M
](https://image.slidesharecdn.com/asam-basakelarutan-230708050717-21e5b4fc/85/asam-basa-kelarutan-ppt-68-320.jpg)