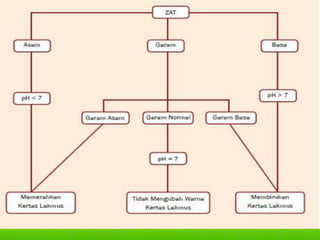
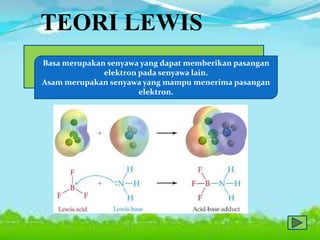
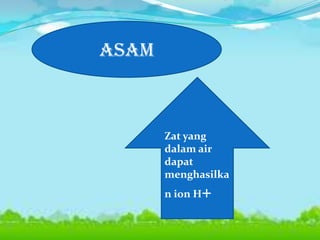
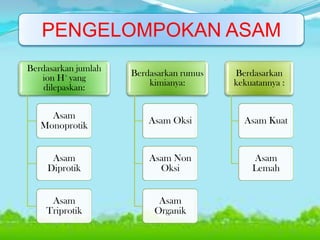
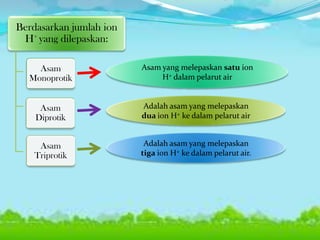
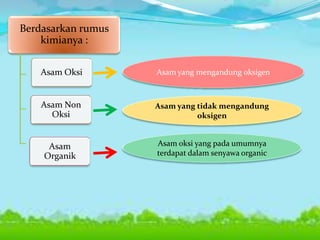
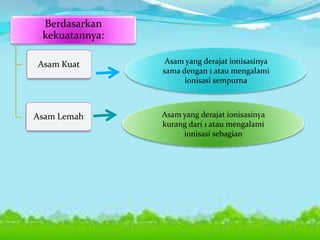
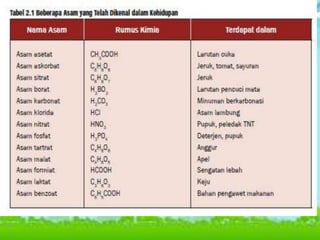
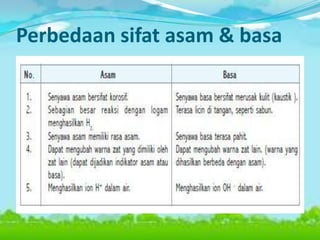
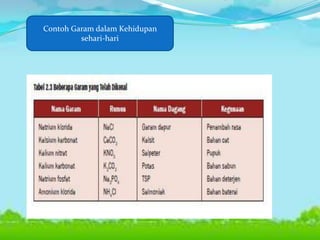
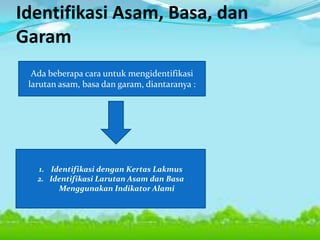
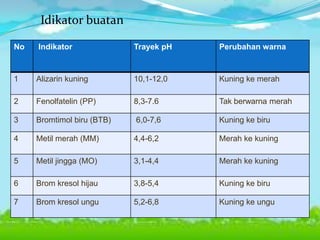
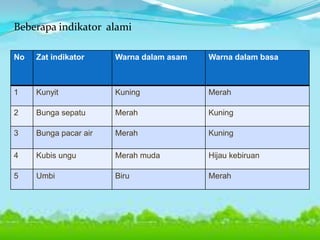
Dokumen tersebut membahas tentang teori asam-basa, jenis-jenis asam dan basa, serta garam. Teori asam-basa meliputi teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam dan basa dibedakan berdasarkan jumlah ion H+/OH- yang dilepaskan, rumus kimia, dan kekuatan. Garam dibentuk dari reaksi antara asam dan basa, dan contohnya adalah garam dapur. Identifikasi asam, basa, dan