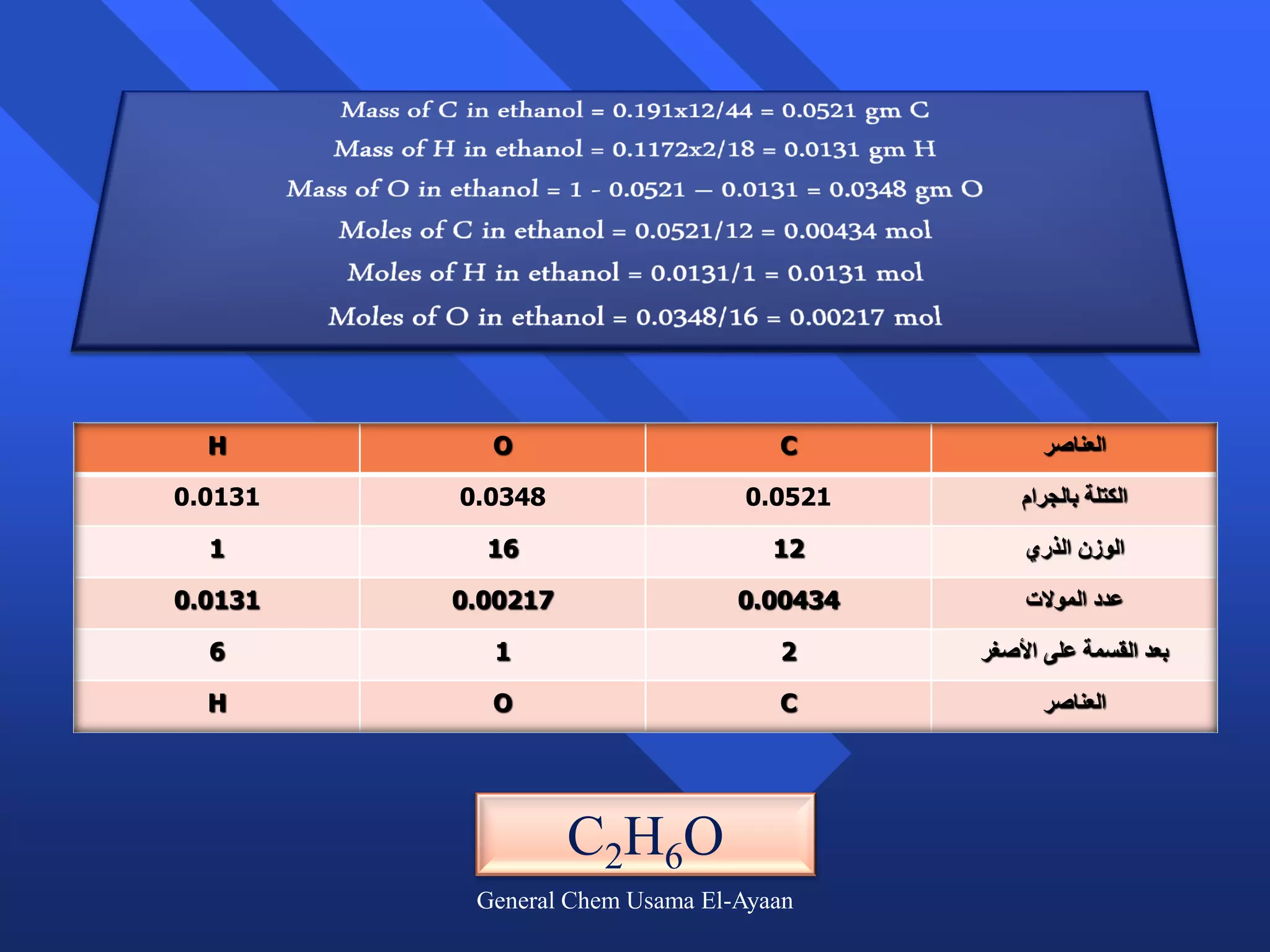
تتناول الوثيقة الحسابات الكيميائية، حيث تم اكتشاف 511 عنصرًا، وتهتم بتفاصيل الوزن الذري والوزن الجزيئي وكيفية حساب عدد المولات. تتناول الوثيقة أيضًا مفهوم النظائر وضبط المعادلات الكيميائية، بالإضافة إلى أمثلة على مسائل رياضية تتعلق بالعناصر والتفاعلات الكيميائية.




![النظائر Isotopes
يه صور خمتلفة للعنرص الواحد تتفق ىف العدد اذلرى وختتلف ىف رمق الكتةل (تتفق يف عدد
الربوتوانت واللكرتوانت وختتلف ىف عدد النيوتروانت). مفثال يوجد ثالث نظائر لللكور يف
الطبيعة فاذا اكنت نس بة تواجد هذه النظائر عيل الرتتيب يه :
,35Cl ,36Cl ,37Cl 35.5Cl
,%5.0 ,%0.57 ,%5.42
فميكن حساب (القمية املتوسطة) للوزن اذلري لللكور اكلتايل:
594.53 = ])001/5.42A = [(35x75.0/100) + (36x0.5/100) + (37x
General Chem Usama El-Ayaan](https://image.slidesharecdn.com/101chapt2usama-130318033745-phpapp01/75/101-chapt2-usama-5-2048.jpg)