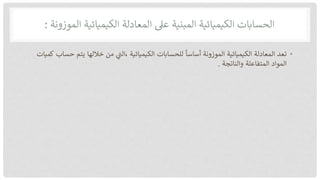
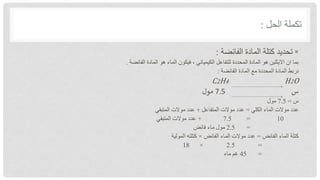
تناقش الوثيقة حسابات الكيمياء المتعلقة بالمعادلات الكيميائية والمفهوم الأساسي للمول. يوضح النص كيفية تحديد الكميات والمتفاعلات والنواتج باستخدام المعادلات الموزونة في التفاعلات الكيميائية. كما يتناول مفهوم المول كوسيلة لقياس المادة ويشمل حساب النسب المئوية للعنصر في المركبات الكيميائية.