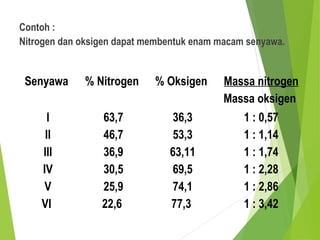
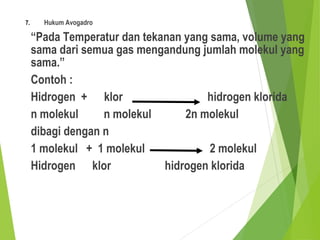
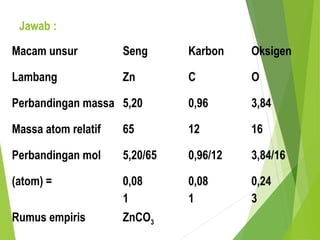
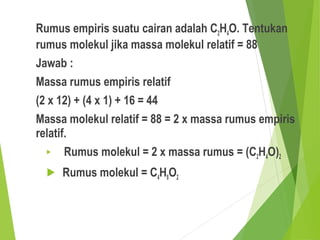
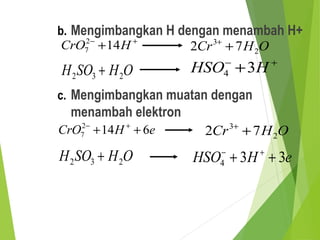
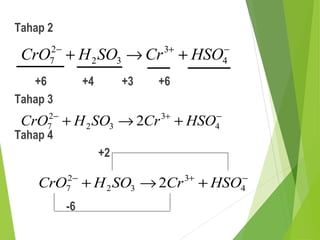
Dokumen ini membahas hukum-hukum dasar dalam kimia, termasuk hukum kekekalan massa, hukum perbandingan tetap, dan hukum kelipatan perbandingan, serta menjelaskan konsep teori atom Dalton dan penerapan konsep mol. Selain itu, dijelaskan pula cara menentukan rumus empiris dan rumus molekul untuk senyawa. Penjelasan mencakup contoh-contoh eksperimen yang menunjukkan penerapan hukum-hukum kimia tersebut.