Buku Ajar Bentuk Molekul.pdf
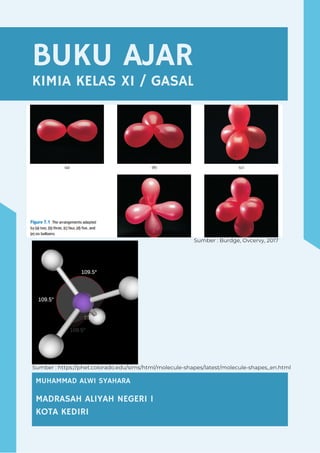
- 1. BUKU AJAR KIMIA KELAS XI / GASAL COMPANY OVERVIEW MUHAMMAD ALWI SYAHARA MADRASAH ALIYAH NEGERI 1 KOTA KEDIRI Sumber : Burdge, Ovcervy, 2017 Sumber : https://phet.colorado.edu/sims/html/molecule-shapes/latest/molecule-shapes_en.html
- 2. KOMPETENSI DASAR 3.6 Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dan Teori Domain elektron dalam menentukan bentuk molekul INDIKATOR PENCAPAIAN KOMPETENSI 3.6.1Menjelaskan konfigurasi elektron pada suatu atom 3.6.2Menentukan elektron valensi suatu atom 3.6.3Meramalkan bentuk molekul berdasarkan konfigurasi elektron 3.6.4Menggambarkan ikatan dengan menggunakan struktur Lewis 3.6.5Menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dalam menentukan bentuk molekul 3.6.6Menerapkan Teori Domain elektron dalam menentukan bentuk molekul 3.6.7Mengaitkan hubungan bentuk molekul dengan kepolaran senyawa BUKU AJAR KIMIA KELAS X MADRASAH ALIYAH NEGERI 1 KOTA KEDIRI 3.6.8Menggambarkan diagram orbital elektron 3.6.9Menjelaskan tipe-tipe hibridisasi ( sp, sp2, sp3, sp3d dan sp3d2 ) 3.6.10Menentukan bentuk molekul berdasarkan teori hibridisasi 3.6.11Menentukan tipe hibridisasi suatu senyawa berdasarkan bentuk molekulnya Menganalisis penyebab perbedaan bentuk molekul pada orbital hibrida / jumlah domain electron yang sama )
- 3. TUJUAN PEMBELAJARAN 1.Peserta didik dapat menjelaskan konfigurasi elektron pada suatu atom dengan benar melalui diskusi kelompok dan kegiatan literasi 2.Peserta didik dapat menentukan elektron valensi suatu atom dengan tepat melalui diskusi kelompok dan latihan soal 3.Peserta didik dapat meramalkan bentuk molekul berdasarkan konfigurasi elektron dengan tepat melalui diskuis kelompok dan kegiatan literasi 4.Peserta didik dapat menggambarkan ikatan dengan menggunakan struktur Lewis dengan benar melalui diskusi kelompok dan latihan soal 5.Peserta didik mampu menerapkan Teori Pasangan Elektron Kulit Valensi (VSEPR) dalam menentukan bentuk molekul dengan benar melalui diskusi kelompok dan kegiatan literasi 6.Peserta didik mampu menerapkan Teori Domain elektron dalam menentukan bentuk molekul dengan benar melalui diskusi kelompok dan kegiatan literasi. 7. Peserta didik dapat mengaitkan bentuk molekul dengan kepolaran senyawa dengan tepat melalui diskusi kelompok dan kegiatan literasi 8. Peserta didik dapat menggambarkan diagram orbital elektron dengan benar melalui kegiatan diskusi kelompok dan literasi 9. Peserta didik mampu menjelaskan tipe-tipe hibridisasi ( sp, sp2, sp3, sp3d dan sp3d2 ) dengan benar melalui kegiatan diskusi dan literasi 10. Peserta didik mampu menentukan bentuk molekul berdasarkan teori hibridisasi dengan tepat melalui kegiatan diskusi dan literasi 11. Peserta didik mampu menentukan tipe hibridisasi suatu senyawa berdasarkan bentuk molekulnya dengan tepat melalui kegiatan diskusi kelompok dan literasi 12. Peserta didik mampu menganalisis penyebab perbedaan bentuk molekul pada orbital hibrida / jumlah domain electron yang sama
- 4. BENTUK MOLEKUL TEORI VALENCE SHELL ELECTRON PAIR OF REPULSION (VSEPR) Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada tolakan pasangan electron disekitar atom pusat. Teori tolakan pasangan elektron ini dikenal dengan istilah VSEPR (Valence Shell Electron Pair of Repulsion). Bentuk molekul didasarkan kepada jumlah electron yang saling tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh mungkin untuk meminimumkan tolakan. Teori VSEPR merupakan penjabaran sederahana dari rumus Lewis yang berguna untuk memprediksikan bentuk molekul poliatom berdasarkan struktur Lewisnya. Teori VSEPR pertama kali dikembangkan oleh NevilSidgwick dan Herbet Powel pada tahun 1940, dan dikembangkan lebihlanjut oleh Ronald Gillespie dan Ronald Nyholm. Sumber : Burdge, Ovcervy, 2017 Sumber : Burdge, Ovcervy, 2017
- 5. Ide dasar teori VSEPR adalah adanya tolakan antara pasangan elektron sehingga pasangan elektron tersebut akan menempatkan diri pada posisi sejauh mungkin dari pasangan elektron lainnya. Posisi pasangan elektron satu dengan yang lain yang semakin berjauhan akan menyebabkan tolakan antar mereka menjadi semakin kecil. Pada posisi yang paling jauh yang dapat dicapai, tolakan antar pasangan elektron menjadi minimal. Tolakan antar pasangan elektron terjadi antara pasangan elektron bebas yang terlokalisasi pada atom pusat dan elektron ikat secara ikatan koordinasi. Teori VSEPR mengasumsikan bahwa masing masing molekul akan mencapai geometri tertentu sehingga tolakan pasangan antar elektron di kulit valensi menjadi minimal. Menurut Ralph H. Petrucci (1985), teori Domain Elektron merupakan penyempurnaan dari teori VSEPR. Teori ini adalah suatu cara meramalkan bentuk molekul berdasarkan tolak menolak elektron- elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. TEORI DOMAIN ELEKTRON Jumlah domain elektron ditentukan sebagai berikut: a. Setiap elektron ikatan (apakah ikatan tunggal, rangkap atau rangkap tiga) merupakan 1 domain. b. Setiap pasangan elektron bebas merupakan 1 domain. Contoh : Tentukan domain elektron atom pusat pada beberapa senyawa : H2O, CO2 dan SO2! Sumber : https://www.istockphoto.com/id/vektor/formula- kimia-dan-model-molekul-metana-ch4- gm692800684-127871183
- 6. Gambarkan struktur lewis masing-masing senyawa Setiap satu elektron ikatan (tunggal, rangkap dua maupun rangkap tiga merupakan satu domain Setiap pasangan elektron bebas merupakan satu domain Pembahasan : Sehingga jumlah domainnya dapat dilihat pada tabel berikut. Penjelasan : 1. Pada struktur lewis H2O atom pusat O dikelilingi oleh 4 PEI sehingga jumlah domain elektron = 4 2. Pada struktur lewis CO2 atom pusat C dikelilingi oleh 2 ikatan rangkap, sehingga domain elektron = 2 3. Pada struktur lewis SO2 atom pusat S dikelilingi oleh dua ikatan rangkap, ikatan tunggal dan 1 PEB, sehingga jumlah domain elektron = 3 Teori domain elektron mempunyai prinsip-prinsip dasar sebagai berikut: a. Antar domain elektron pada kulit luar atom pusat saling tolak- menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum. b. Urutan kekuatan tolak-menolak di antara domain elektron adalah: Tolakan antar domain elektron bebas > tolakan antara domain elektron bebas dengan domain elektron ikatan > tolakan antara domain elektron ikatan. c. Bentuk molekul hanya ditentukan oleh pasangan elektron ikatan.
- 7. Rumusan tipe molekul dapat ditulis dengan lambang AXnEm (jumlah pasangan electron), pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) RUMUS/TIPE MOLEKUL dimana : A : Atom pusat X : Jumlah pasangan elektron ikatan (PEI) E : jumlah pasangan elektron bebas (PEB) Catatan: a. ikatan rangkap dua atau rangkap tiga dihitung satu pasang electron ikatan b. tolakan antara PEB-PEB> PEB-PEI>PEI-PEI c. PEI menentukan bentuk molekul,PEB mempengaruhi besar sudaut ikatan Langkah-langkah memprediksi bentuk molekul dengan teori VSEPR a. Tentukan struktur lewis dari rumus molekul b. Tentukan jumlah PEB dan PEI atom pusat c. Tentukan tipe/rumus molekulnya d. Gambar bentuk molekul dan beri nama sesuai dengan jumlah PEI dan PEB Sumber : Mendera, 2020
- 8. 1. Senyawa metana, CH4 Struktur lewisnya dapat digambarkan sebagai berikut CONTOH Dari struktur lewisnya, bahwa atom pusat, C memiliki empat pasangan elektron ikatan (PEI) dan tidak memiliki pasangan elektron bebas (PEB), sehingga tipe molekulnya adalah AX4. Pasangan elektron ikatan akan menempati posisi dimana tolakan sekecil mungkin, sehingga posisi PEI antara satu dengan yang lain menjadi sama jaraknya dan menghasilkan sudut antara H – C – H yang sama besarnya, sehingga berdasarkan rumus/tipe molekulnya, CH4 memiliki bentuk tetrahedral seperti tampak pada gambar berikut. 2. Senyawa amonia, NH3 Struktur lewis NH3 adalah sebagai berikut : Pembahasan : Atom pusat adalah N mempunyai elektron valensi 5 Pasangan Eekton ikatan (X) = 3 Pasangan Elektron Bebas E = (5- 3)/2 = 1 Bentuk molekul AX3E bentuk molekulnya piramida segitiga Sumber : https://phet.colorado.edu/sims/html /molecule-shapes/latest/molecule- shapes_en.html Sumber : https://phet.colorado.edu/sims/html /molecule-shapes/latest/molecule- shapes_en.html Sumber : Mendera, 2020 Sumber : Mendera, 2020
- 9. Dengan menggunakan teori VSEPR maka kita dapat meramalkan bentuk geometri suatu molekul, seperti terlihat pada tabel berikut. Sumber : Mendera, 2020
- 10. Sumber : Mendera, 2020
- 11. TEORI HIBRIDISASI ELEKTRON Hibridisasi merupakan gambaran mekanika kuantum tentang ikatan kimia. Hibridisasi adalah proses dimana orbital atom bergabung membentuk orbital hibrida yang memiliki tingkat energi yang sama. Orbital-orbital ini kemudian berinteraksi dengan orbital atom yang lain untuk membentuk ikatan kimia. Berbagai bentuk molekul dapat dihasilkan dari hibridisasi yang berbeda. Konsep hibridisasi dapat menjelaskan pengecualian aturan oktet dan juga menjelaskan pembentukan ikatan rangkap dua dan ikatan rangkap tiga. Hibridisasi pada molekul yang memiliki Ikatan Tunggal Hibridisasi sp Hibridisasi pada BeCl2 adalah sebagai berikut. Diagram orbital untuk elektron valensi Be Diagram orbital Be untuk electron tereksitasi Pada Be terdapat dua orbital yang tersedia untuk ikatan, yaitu 2s dan 2p. Tetapi, jika dua atom Cl bergabung dengan Be dalam keadaan tereksitasi ini, elektron dari satu atom Cl akan berpasangan dengan elektron 2s dan electron dari satu atom Cl yang lain akan berpasangan dengan elektron 2p. Dua ikatan BeCl tersebut tidak setara dan ini bertentangan dengan bukti percobaan. Dalam molekul BeCl2 yang sebenarnya, kedua ikatan BeCl setara. Jadi orbital 2s dan 2p harus berhibridisasi dahulu , untuk membentuk dua orbital hibrida sp yang setara.
- 12. Hibridisasi sp Hibridisasi pada BeCl2 adalah sebagai berikut. Diagram orbital untuk elektron valensi Be Diagram orbital Be untuk electron tereksitasi TEORI HIBRIDISASI ELEKTRON Hibridisasi merupakan gambaran mekanika kuantum tentang ikatan kimia. Hibridisasi adalah proses dimana orbital atom bergabung membentuk orbital hibrida yang memiliki tingkat energi yang sama. Orbital-orbital ini kemudian berinteraksi dengan orbital atom yang lain untuk membentuk ikatan kimia. Berbagai bentuk molekul dapat dihasilkan dari hibridisasi yang berbeda. Konsep hibridisasi dapat menjelaskan pengecualian aturan oktet dan juga menjelaskan pembentukan ikatan rangkap dua dan ikatan rangkap tiga. Pada Be terdapat dua orbital yang tersedia untuk ikatan, yaitu 2s dan 2p. Tetapi, jika dua atom Cl bergabung dengan Be dalam keadaan tereksitasi ini, elektron dari satu atom Cl akan berpasangan dengan elektron 2s dan electron dari satu atom Cl yang lain akan berpasangan dengan elektron 2p. Dua ikatan BeCl tersebut tidak setara dan ini bertentangan dengan bukti percobaan. Dalam molekul BeCl2 yang sebenarnya, kedua ikatan BeCl setara. Jadi orbital 2s dan 2p harus berhibridisasi dahulu , untuk membentuk dua orbital hibrida sp yang setara. Diagram orbital Be terhibridisasi
- 13. Hibridisasi sp2 Molekul BF3 memiliki hibridisasi sp2 Diagram orbital B adalah . Diagram orbital B tereksitasi Pencampuran orbital 2s dan dua orbital 2p mengasilkan tiga orbital hibrida sp2 Kedua orbital hibrida ini terletak pada garis yang sama, sehingga sudut diantaranya adalah 180o . Maka setiap ikatan BeCl terbentuk akibat tumpangtindih dari satu orbital hibrida sp dari Be dengan satu orbital 3p dari Cl, dan menghasilkan molekul BeCl2 yang memiliki geometri linier ketiga orbital sp2 ini terletak pada bidang yang sama, dan membentuk sudut 120o antara satu dengan lainnya. Setiap ikatan BF terbentuk dari tumpang-tindih orbital hibrida sp2 boron dan orbital 2p fluorin. Molekul BF3 berbentuk datardengan semua sudut FBF sama dengan 120o . Hal ini sesuai dengan hasil percobaan juga ramalan teori VSEPR Sumber : Devi, 2016 Sumber : Devi, 2016
- 14. Pencampuran orbital 2s dan tiga orbital 2p mengasilkan empat orbital hibrida sp3 Hibridisasi sp3 Molekul CH4 memiliki bentuk molekul tetrahedral berdasarkan teori VSEPR. Diagram orbital C adalah Diagram orbital C tereksitasi Hibridisasi sp3d Molekul PCl5 memiliki bentuk molekul bipiramida trigonal berdasarkan teori VSEPR. Diagram orbital P adalah Diagram orbital P tereksitasi Gambar Orbital sp3 pada CH4 adalah sebagai berikut. Sumber : Devi, 2016
- 15. Hibridisasi sp3d 2 Molekul SF6 memiliki bentuk molekul oktahedral berdasarkan teori VSEPR. Diagram orbital S adalah Diagram orbital S terhibridisasi tereksitasi Lima elektrón yang tidak berpasangan pada orbital sp3 d akan berpasangan dengan electrón dari atom Cl. Bentuk orbital PCl5 adalah bipiramidal trigonal Pencampuran orbital 2s dan tiga orbital 2p dan 1 orbital 3d mengasilkan lima orbital hibrida sp3 d Pencampuran orbital 2s dan tiga orbital 2p dan 2 orbital 3d mengasilkan lima orbital hibrida sp3 d 2 Enam elektrón yang tidak berpasangan pada orbital sp3 d 2 akan berpasangan dengan elektrón dari atom F. Bentuk orbital SF6 adalah oktahedral
- 16. 2. Unsur berikut yang memiliki elektron valensi yang cukup untuk berikatan dengan unsur 6C membentuk geometri molekul tetrahedral adalah… a. 1H b. 3Li c. 7N d. 8O e. 11Na 1. Perhatikan notasi unsur berikut : 19 K 39 Konfigurasi electron ion K+ adalah . . . a. 1s2 2s2 2p 6 3s2 3p5 b. 1s 2 2s2 2p 6 3s2 3p6 c. 1s 2 2s2 2p 6 3s2 3p5 4s1 d. 1s 2 2s2 2p 6 3s2 3p5 4s3 1s 2 2s2 2p 6 3s2 3p5 4s2 4p1 3. Struktur Lewis yang benar untuk senyawa PCl3 adalah……… (nomor atim P = 15 dan Cl = 17) TES FORMATIVE 1
- 17. 5. Bila diketahui no atom H = 1 dan O = 16 membentuk molekul H2O dengan tipe molekul dan bentuk molekul secara berturut-turut.... a.AX4, tetrahedral b.AX3E, segitiga piramid c.AX2E2, planar bentuk V d.AXE3, segitiga palar AX3E2, segitiga bipiramidal 4. Konfigurasi atom unsur P dan Q adalah sebagai berikut. P : 1s2 2s2 2p2 Q : 1s2 2s2 2p6 3s2 3p5 Jika P dan Q membentuk senyawa PQ4, bentuk molekulnya adalah…. a. linier b. segitiga piramida c. tetrahedral d. segi empat planar e. segitiga bipiramida 6. Notasi VSEPR untuk molekul PF5 adalah…(nomor atom P = 15 dan F = 9) a. AX3 b. AX5 c. AX4E d. AX3E2 e. AX2E3 7. Perhatikan tabel berikut Pernyataan yang benar hbungan antara jumlah PEI, PEB dan bentuk molekul adalah....
- 18. 8. Molekul suatu senyawa memiliki PEI = 3 dan PEB = 2, bentuk molekul dan gambar bentuk paling yang mungkin adalah.... a.(1) dan (2) b.(1) dan (3) c.(2) dan (3) d.(2) dan (4) e.(4) dan (5)
- 19. 10. Berdasarkan bentuk molekulnya, perkirakan senyawa manakah berikut yang bersifat polar? a.CCl4 b.CO2 c.PCl5 d.CH4 e. PCl3 9. Jika 4X dan 17Y berikatan, bentuk molekul dan sifat kepolaran yang terbentuk adalah …. a.segiempat planar dan polar b.linear dan polar c.tetrahedral dan nonpolar d.oktahedral dan nonpolar e. linear dan nonpolar
- 20. 2. Diagram orbital yang paling tepat untuk elektron terakhir dari unsur 12 X 24adalah....(Nomor atom Ne = 10, Ar = 18) 1.Perhatikan dua buah diagram orbital unsur berikut ini: Nomor atom yang tepat untuk unsur X dan Y berturut-turut adalah ... a.7 dan 4 b.8 dan 14 c.8 dan 22 d.16 dan 18 e. 16 dam 22 3. CH4 mempunyai struktur tetrahedral, dengan empat buah domain elektron ikatan pada empat arah yang sama. Maka bentuk hibridisasi yang terjadi pada CH4 adalah …. a.sp b.sp2 c.sp3 d.sp3d e. sp3d2 4. Pasangan yang tidak mungkin terjadi antara bentuk hibridisasi dan bentuk molekul suatu senyawa adalah … TES FORMATIVE 2
- 21. 5. Molekul dengan orbital hibrida sp2 memiliki bentuk orbital … a.Linear b.segitiga datar c.segitiga piramida d.tetrahedral e. oktahedral a.sp – linear b.sp3 – segi empat planar c.sp3 – bentuk bengkok d.sp3 – tetrahedral e. sp3 – trigonal bipiramida 6. Bentuk hibrida dari beberapa senyawa: No. Rumus Senyawa Bentuk Hibrida 1 CH4 sp2 2 HCl Sp 3 H2O dsp2 4 NH3 sp3d2 5 Ag(NH3)2 d2sp3 Dari data tersebut yang merupakan pasangan yang tepat adalah …. a.1 b.2 c.3 d.4 e. 5 7. Bentuk molekul bipiramida trigonal memiliki orbital hibrida … a.sp b.sp2 c.sp3 d.sp3d e. sp3d2
- 22. 9. Sudut ikatan molekul H2O adalah 104,5 lebih kecil dari sudut tetrahedron, hal ini disebabkan oleh …. a. adanya 2 pasangan elektron bebas b. adanya 2 pasangan elektron ikatan c. adanya ikatan hidrogen pada H2O d. adanya dipol permanen pada H2O e. pasangan elektron jauh dari atom pusat 8. Jika nomor atom B adalah 5 dan nomor atom F adalah 9, maka hibridisasi dari BF3 adalah …. a.sp b.sp2 c.sp3 d.sp3d e. sp3d2 10. Senyawa berikut yang mempunyai sudut ikatan lebih kecil dari sudut ikatan NH3 adalah …. a. MgCl2 b. CH4 c. C2H4 d. SCl2 e. BF3
- 23. Overby, J., Burdge, J. (2017). Loose Leaf for Chemistry: Atoms First. Amerika Serikat: McGraw-Hill Education. DAFTAR PUSTAKA Devi, Popi Kamalia. (2016). Metode dan Pendekatan Pembelajaran. Dirjen GTK: PPPPTK IPA. Mendera, I Gede. (2020). Modul Pembelajaran SMA: Bentuk Molekul. Dirjen PAUD, Dikdas, Dikmen: Direktorat SMA. Sudarmono, Unggul. 2013. Buku Kimia Kelas XI, Bahan ajar . Kimia untuk SMA/MA kelas X Erlangga: Jakarta