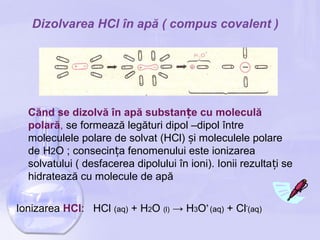
Documentul discută despre soluții apoase, definind termenii de solvat și solvent, și describe procesele de dizolvare, ionizare și hidratare a ionilor, folosind exemple precum HCl și NaCl. De asemenea, sunt prezentate conceptele de solubilitate, soluție saturată și nesaturată, precum și factorii care influențează solubilitatea. În final, se abordează concentrația soluțiilor, inclusiv concentrația procentuală și molară, însoțită de exerciții de evaluare.





![Concentraţia soluţiilor
Concentraţia soluţiilor reprezintă cantitatea de substanţă
dizolvată într-o anumită cantitate (volum) de solvent sau
soluţie.
1. Concentraţia procentuală
Concentraţia procentuală de masă: reprezintă cantitatea de substanţă dizolvată,
exprimată în grame din 100 g de soluţie.
= ms = md + msolv
unde: c% – concentraţia procentuală de masă[%] ;
md – masa soluţie [g]; ms – masa soluţiei [g];
msolv. – masa solventului [g].
Concentraţia procentuală de volum: exprimă numărul de litri de dizolvat din 100 l de
soluţie.
= Vs = Vd + Vsolv.
unde: c%– concentraţia procentuală de masă[%] , Vd – volumul soluţiei [l];
Vs – volumul soluţiei [l]; Vsolv. – volumul solventului [l].
Acest mod de exprimare a concentraţiei se aplică atunci când componentele soluţiei
sunt gaze.
Concentraţia procentuală volumetrică: reprezintă grame de solut la 100 ml soluţie.
100⋅
s
d
m
m
100⋅
s
d
V
V
%c
%c](https://image.slidesharecdn.com/solutiiapoase-150304093459-conversion-gate01/85/Solutii-apoase-7-320.jpg)
![Concentraţia molară (molaritatea)
- reprezintă numărul de moli de substanţă dizolvată într-un
litru de soluţie.
cm = [mol/l ]
unde: cm – concentraţia molară [mol/l];
Md – masa molară a solvatului [g].
Sd
d
VM
m
⋅](https://image.slidesharecdn.com/solutiiapoase-150304093459-conversion-gate01/85/Solutii-apoase-8-320.jpg)


