Документ представляет собой лекцию о строении атомов и молекул, обсуждающую ключевые концепции в химии и физике, такие как структуры атомов, молекулярные орбитали и химические связи. Раскрываются исторические аспекты открытия электричества и электрона, работа Э. Резерфорда и Н. Бора, которые привели к пониманию планетарной модели атома. Включены сведения о поляризации химических связей и процессе каталитических реакций, а также роли гемоглобина и хлорофилла в биохимии.





![Планетарная модель
атома Бора-Резерфорда
• В 1911 году[3] Эрнест Резерфорд,
проделав ряд опытов по
рассеиванию альфа-частиц, пришёл к
выводу, что атом представляет собой
подобие планетной системы, в
которой электроны движутся по
орбитам вокруг расположенного в
центре атома тяжёлого
положительно заряженного ядра
(«модель атома Резерфорда»).
• Нильс Бор ввел постулаты: электрон
в атоме, находясь в некоторых
специальных энергетических
состояниях, не излучает энергию.
Изучение излучения атома привело к
созданию квантовой механики
E. Rutherford
Нобелевский Лауреат 1908 год (химия)
«All science is either physics
or stamp collecting»
.](https://image.slidesharecdn.com/reaviz9-2-140905054128-phpapp01/85/Reaviz-9-2-6-320.jpg)


![Закон Мозли: корень квадратный из частоты n
спектральной линии характеристического РЕНГЕНОВСКОГО
излучения элемента есть линейная функция
его порядкового номера Z
• Это открытие имело огромное значение для
установления физического смысла
периодической системы элементов и
атомного номера и для подтверждения
правильности концепции планетарного атома
• В 1962 г. Нильс Бор заметил:
• «Вы знаете, работы Резерфорда [по
атомному ядру] не считались серьёзными.
Сегодня мы не можем в это поверить, но
они вовсе не рассматривались серьёзно.
Никто и нигде про них не упоминал. И
только после работ Мозли все
изменилось».
Henry Moseley
1887 – 1915 (27 лет)
Погиб в 1-ю Мировую
на Турецком фронте](https://image.slidesharecdn.com/reaviz9-2-140905054128-phpapp01/85/Reaviz-9-2-9-320.jpg)







![По сравнению с методом валентных схем МО ЛКАО имеет
следующие преимущества:
• Позволяет описывать
химическую связь ДАЖЕ в:
• электронодефицитных
молекулах (диборан),
• молекулярных радикалах (
монооксид азота),
• молекулярных ионах (нитрозил,
нитроил, гидразоний,
оксигенил),
• гипервалентных соединениях
(соединения благородных газов
).
• Объясняет образование молекул с
многоцентровыми орбиталями.
Например, в азотной кислоте азот
имеет степень окисления +5, хотя
предельное число связей не может
быть больше числа валентных
орбиталей (то есть 4). Это
противоречие разрешается исходя
из модели трёхцентровой
двухэлектронной связи.
• Описывает водородную связь как
частный случай ковалентной: через
модель делокализации электронной
плотности и образование
трёхцентровых четырёхэлектронных
связей (например, -H•••[F-H•••F]-).](https://image.slidesharecdn.com/reaviz9-2-140905054128-phpapp01/85/Reaviz-9-2-17-320.jpg)

















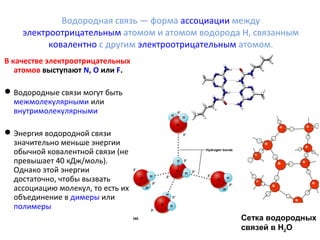

![Если в качестве ЭО атомов выступают атомы
КИСЛОРОДА, то энергия водородной связи также
велика кДж/моль).
В составе каждой молекулы воды ион H+
не имеет внутренних электронных слоев и
обладает малыми размерами, в результате чего
он может проникать в электронную оболочку
отрицательно поляризованного атома кислорода
соседней молекулы, образуя водородную связь с
другой молекулой.
Каждая молекула воды связана с четырьмя
другими посредством водородных связей —
две из них образует атом кислорода и две
атомы водорода[9].
Комбинация этих связей между молекулами воды — полярной и
водородной и определяет очень высокую температуру её кипения и
удельную теплоты парообразования[9].
В результате этих связей в водной среде возникает давление в
15-20 тыс. атмосфер, которое и объясняет причину трудносжимаемости
воды, так при увеличении атмосферного давления на 1 бар, вода
сжимается на 0,00005 доли её начального объёма](https://image.slidesharecdn.com/reaviz9-2-140905054128-phpapp01/85/Reaviz-9-2-37-320.jpg)
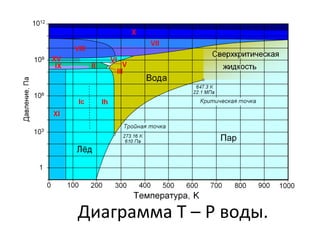
![• При нормальных условиях вода
слабо диссоциирована и
концентрация ионов гидроксония
H3O
+ и гидроксильных ионов HO−
составляет 0,1 мкмоль/л.
• Но поскольку вода — хороший
растворитель, в ней практически
всегда растворены те или иные
соли, то есть в воде присутствуют
положительные и отрицательные
ионы.
• Благодаря этому вода проводит
электричество. По
электропроводности воды можно
определить её чистоту.
Структуры воды и льда между собой
очень похожи[9]. В воде, как и во льду,
молекулы стараются расположиться в
определённом порядке — образовать
структуру, однако тепловое движение этому
препятствует.
У воды самая большая удельная
теплоёмкость среди прочих жидкостей и
твёрдых веществ. Для того чтобы нагреть
один литр воды на один градус, требуется
затратить 4,1868 кДж энергии.
Вода также имеет большие
значения удельной
теплоты плавления (0 °C и
333,55 кДж/кг) и
парообразования (2250
кДж/кг).](https://image.slidesharecdn.com/reaviz9-2-140905054128-phpapp01/85/Reaviz-9-2-38-320.jpg)