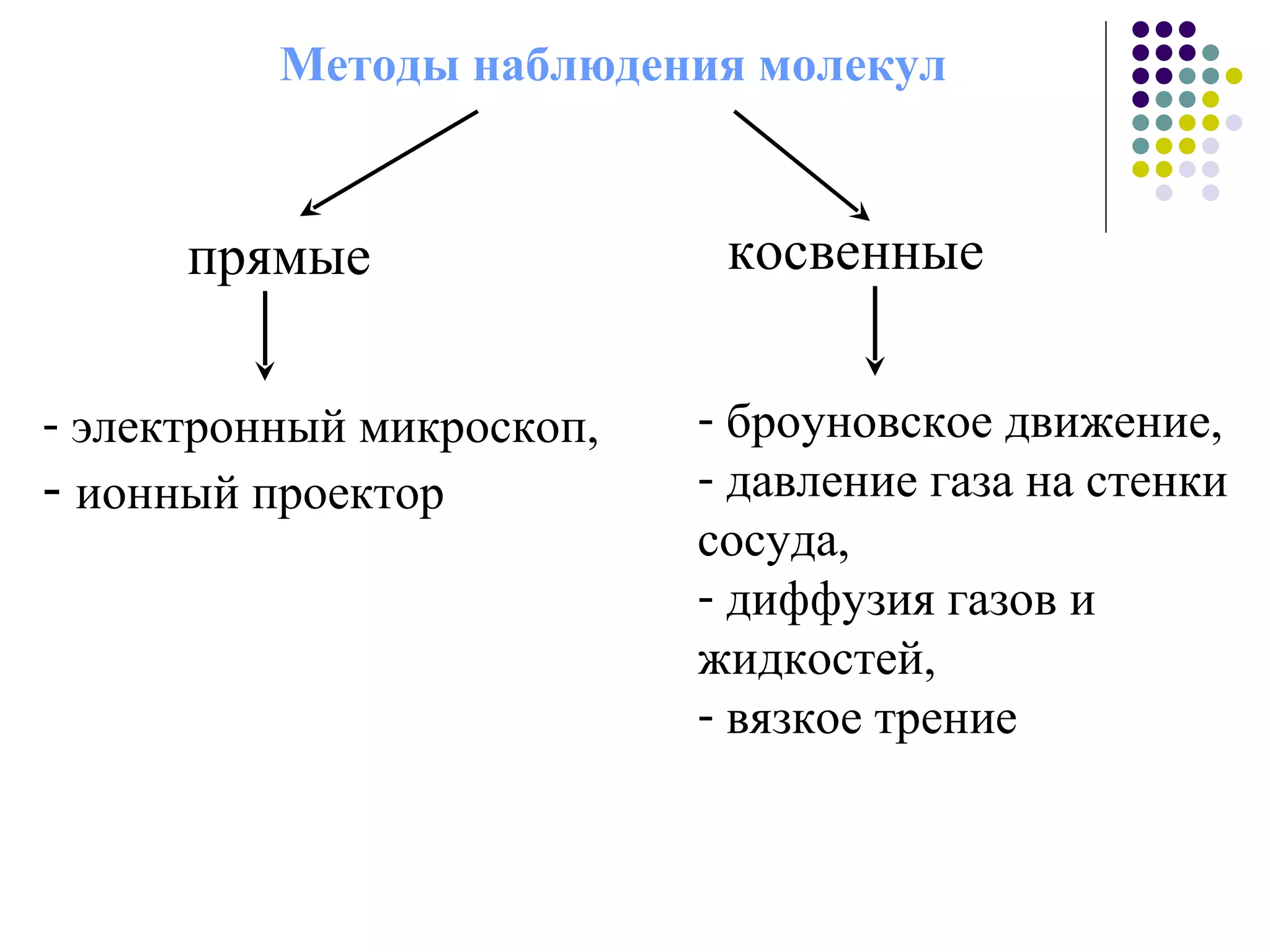
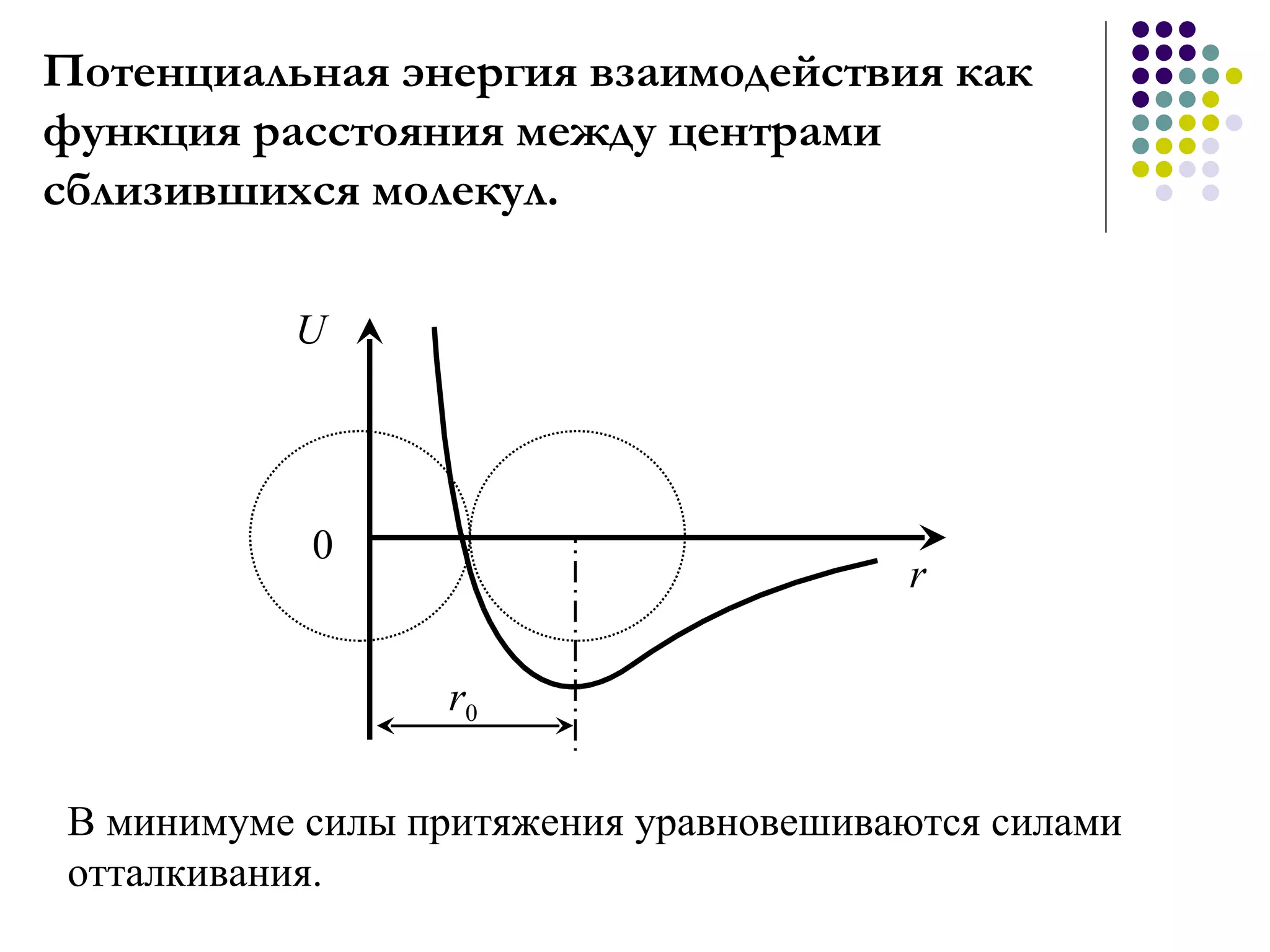
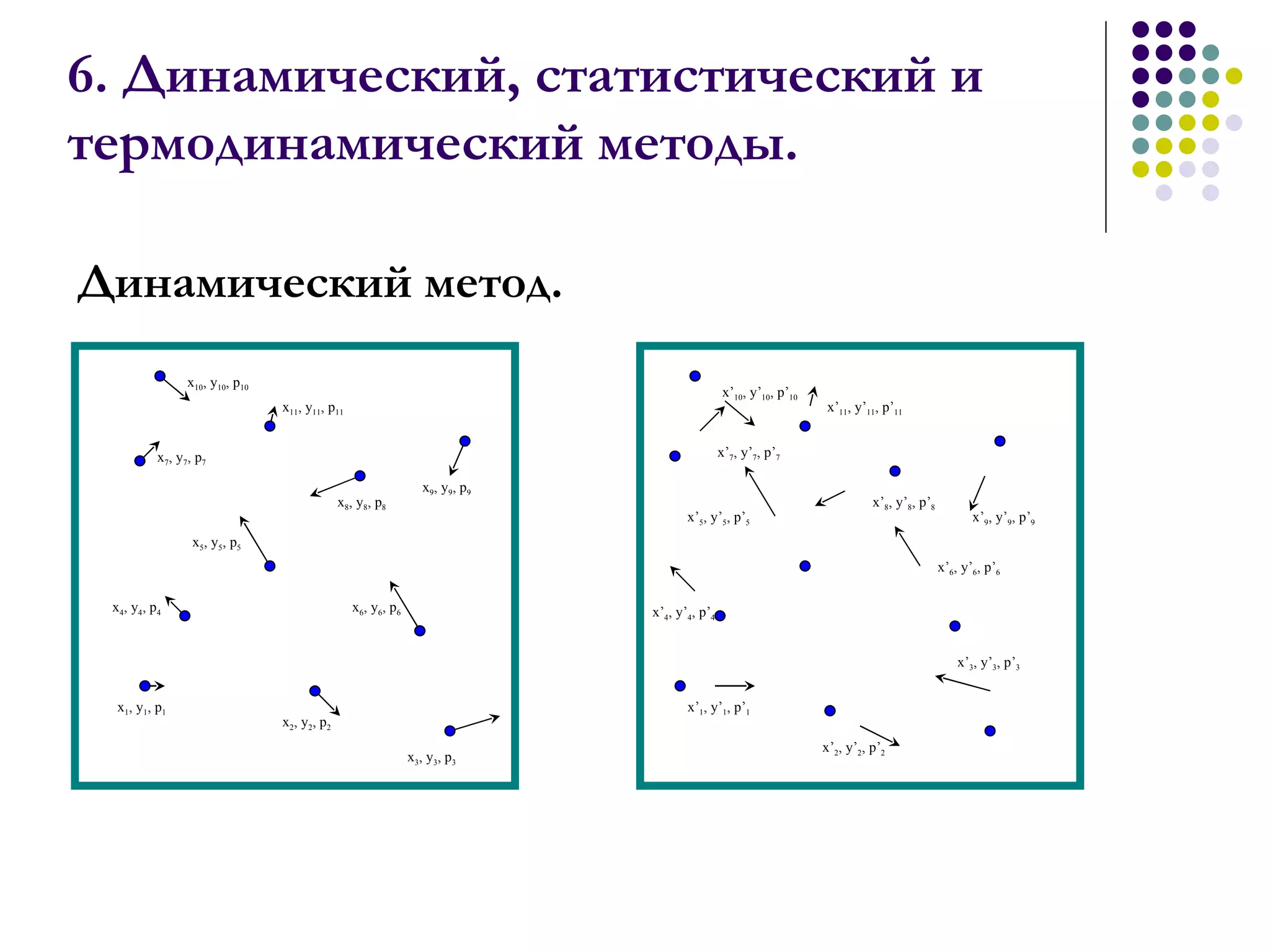
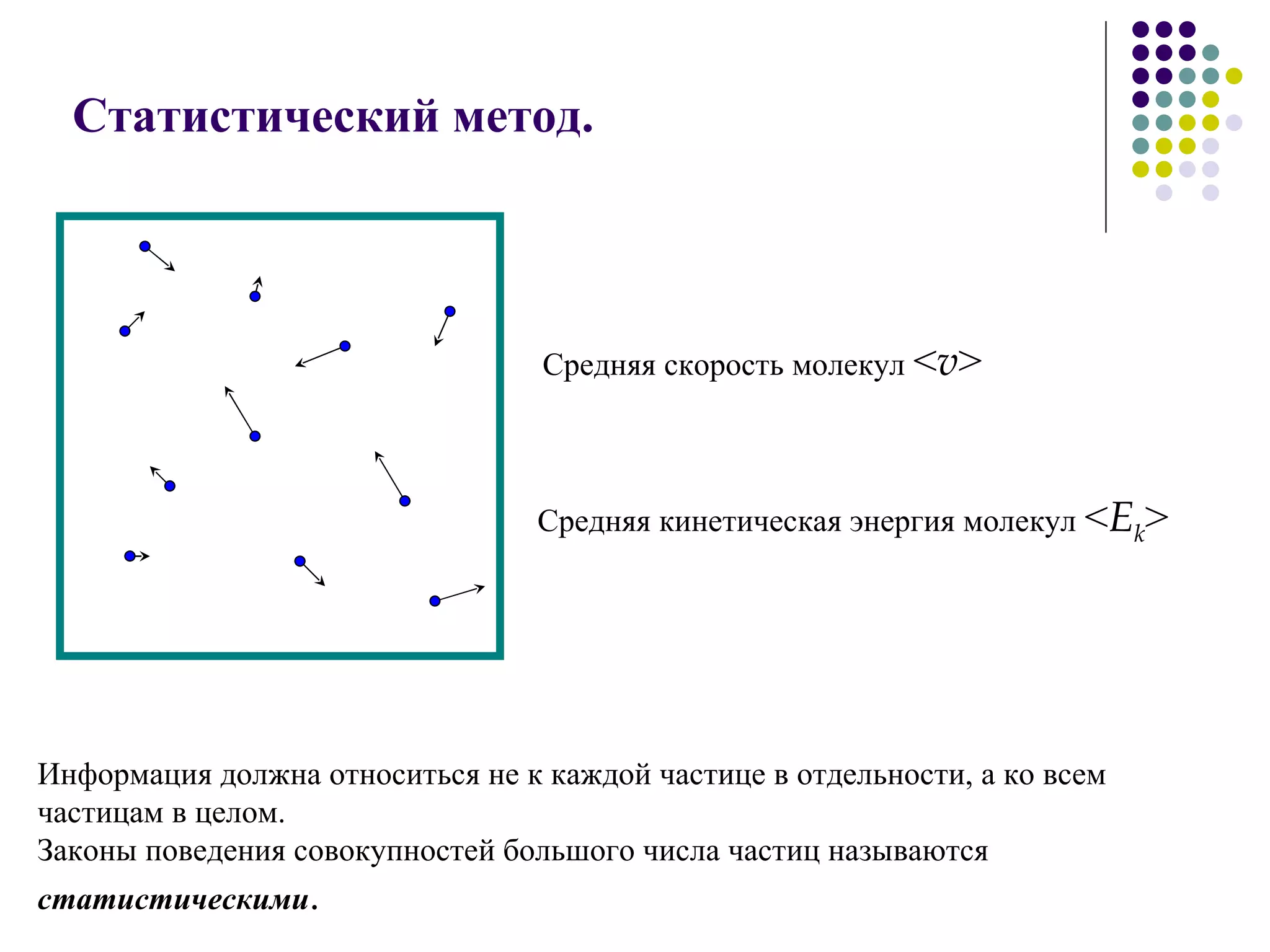
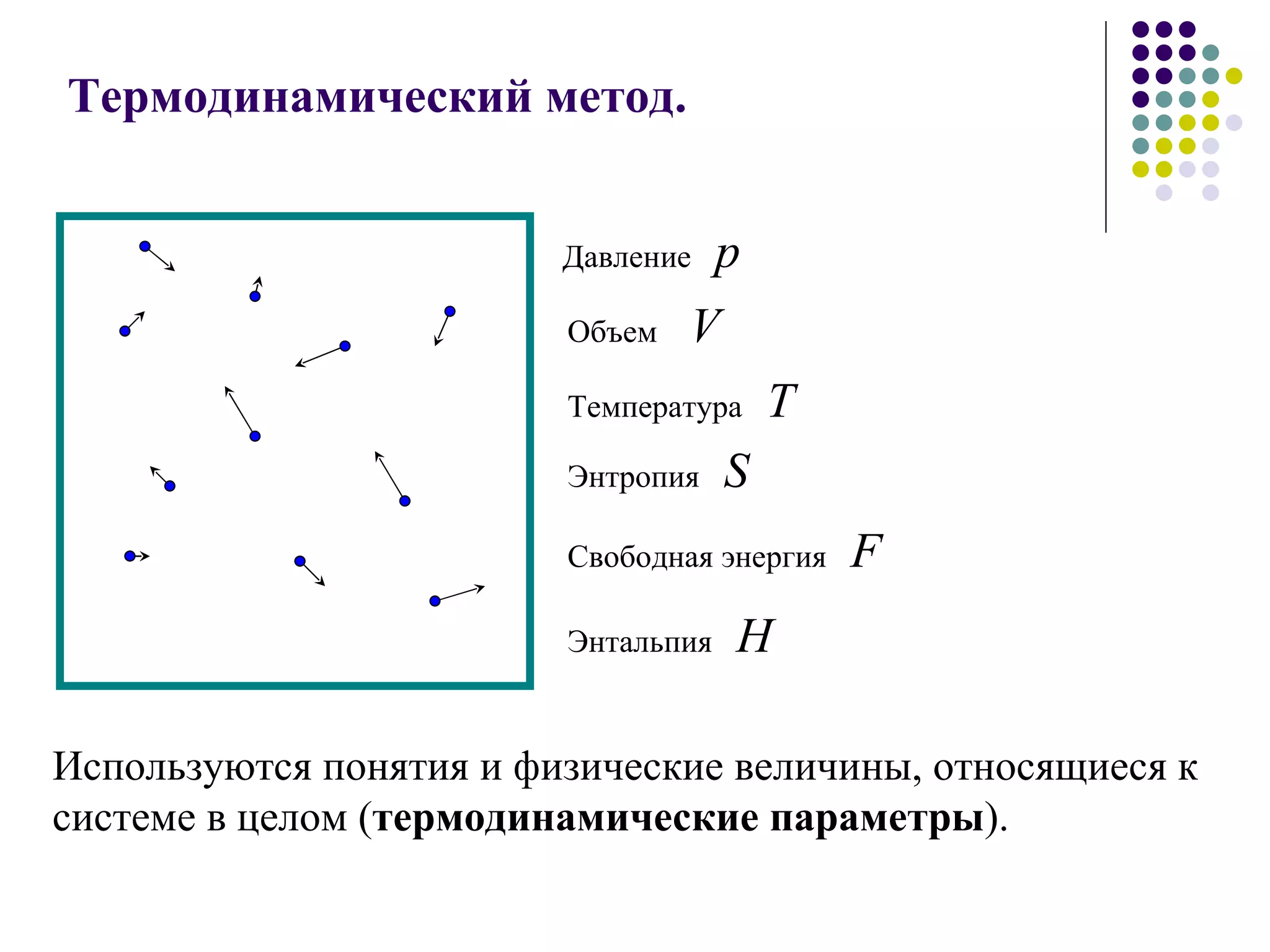
Документ посвящен основам молекулярной физики, включая статистическую физику и термодинамику. Рассматриваются методы наблюдения молекул, характеристики массы и размеров атомов, количество вещества, агрегатные состояния и модель идеального газа. Также отмечено использование динамических, статистических и термодинамических методов для анализа систем многих частиц.