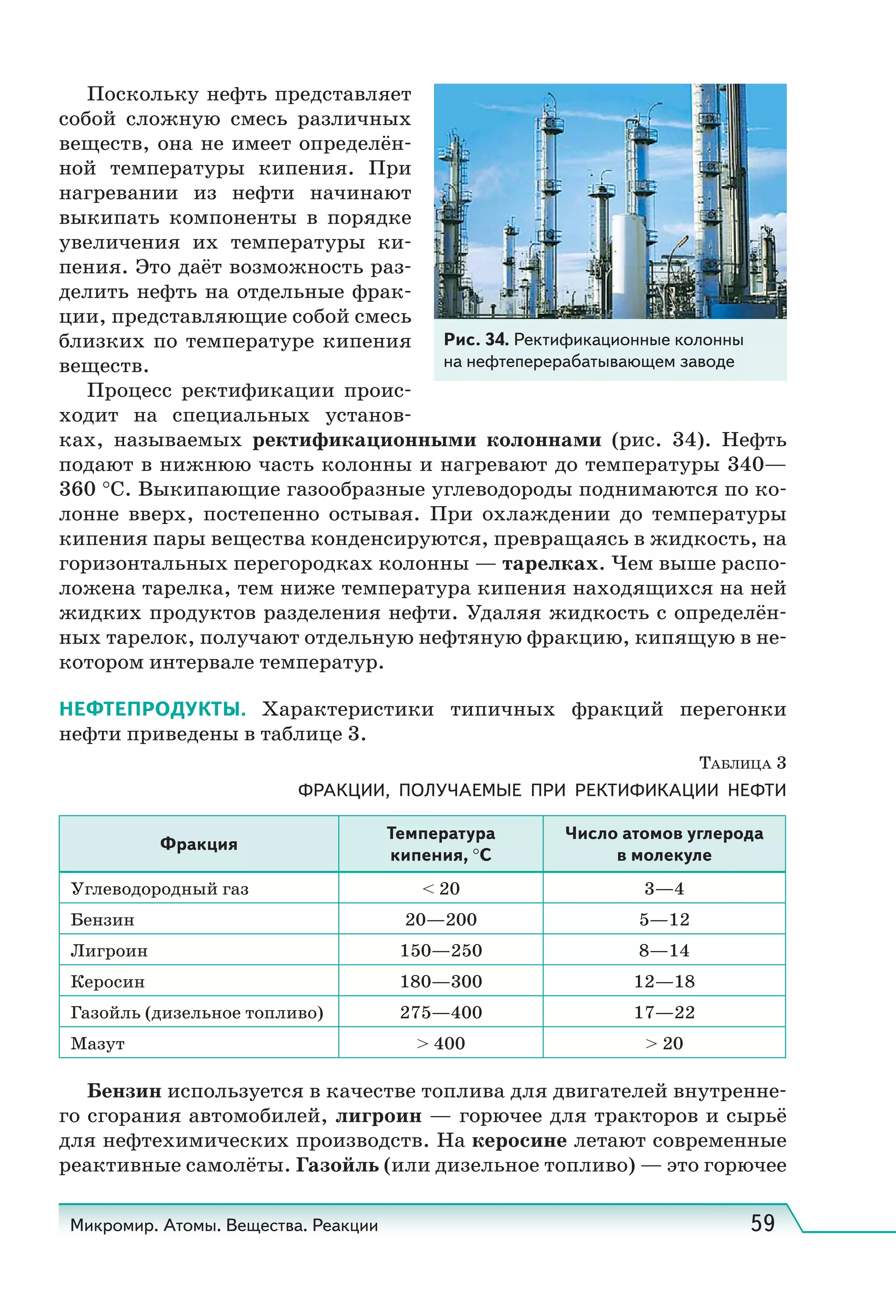
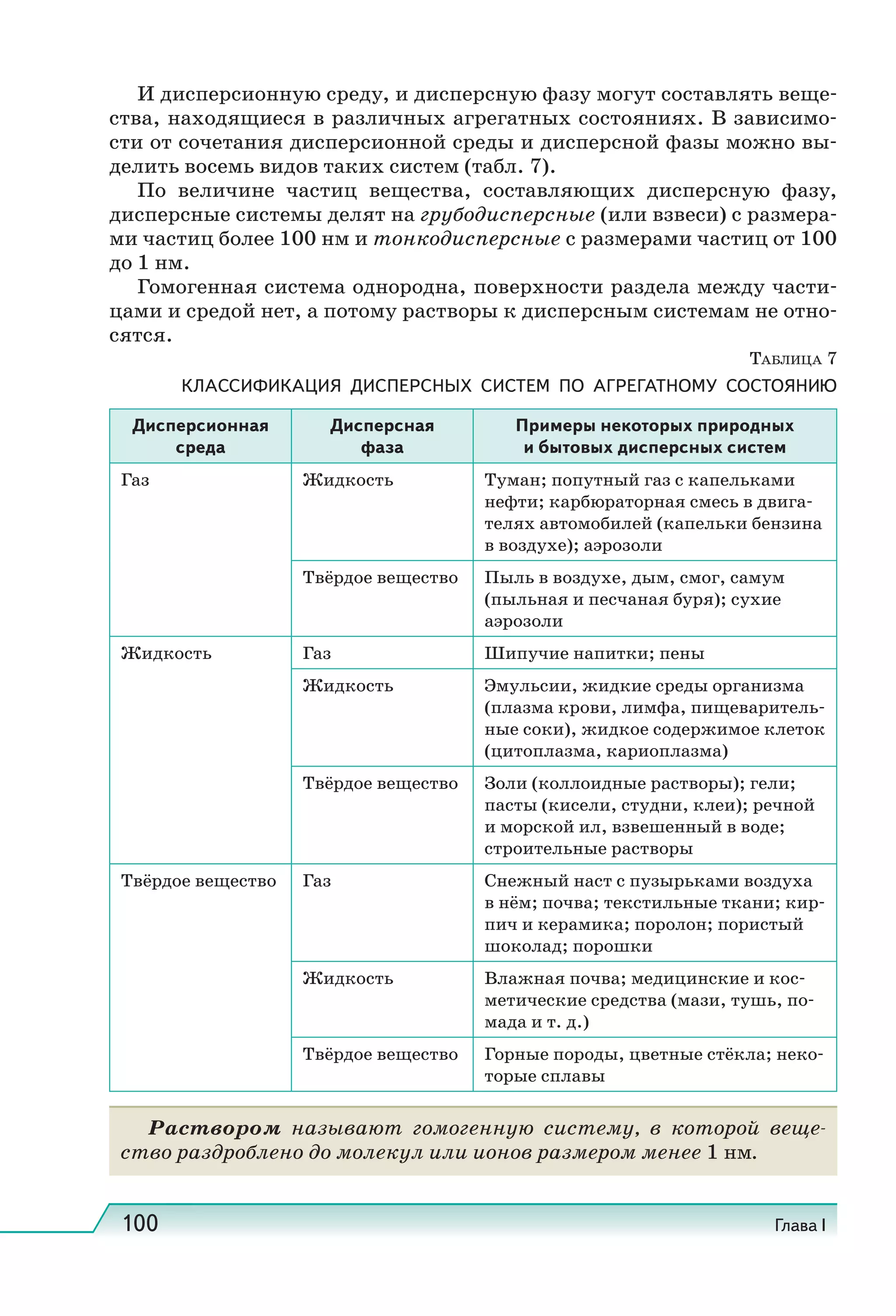
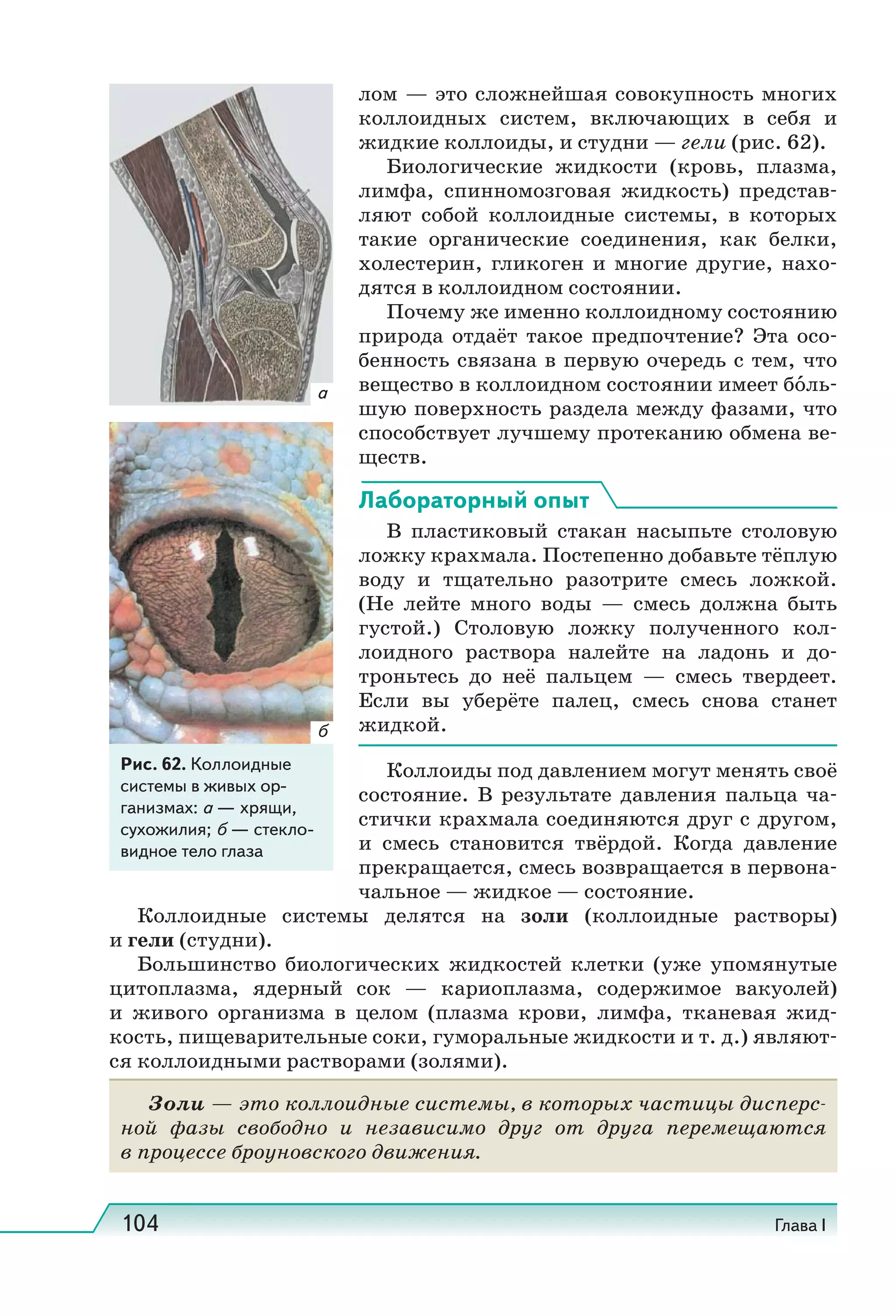
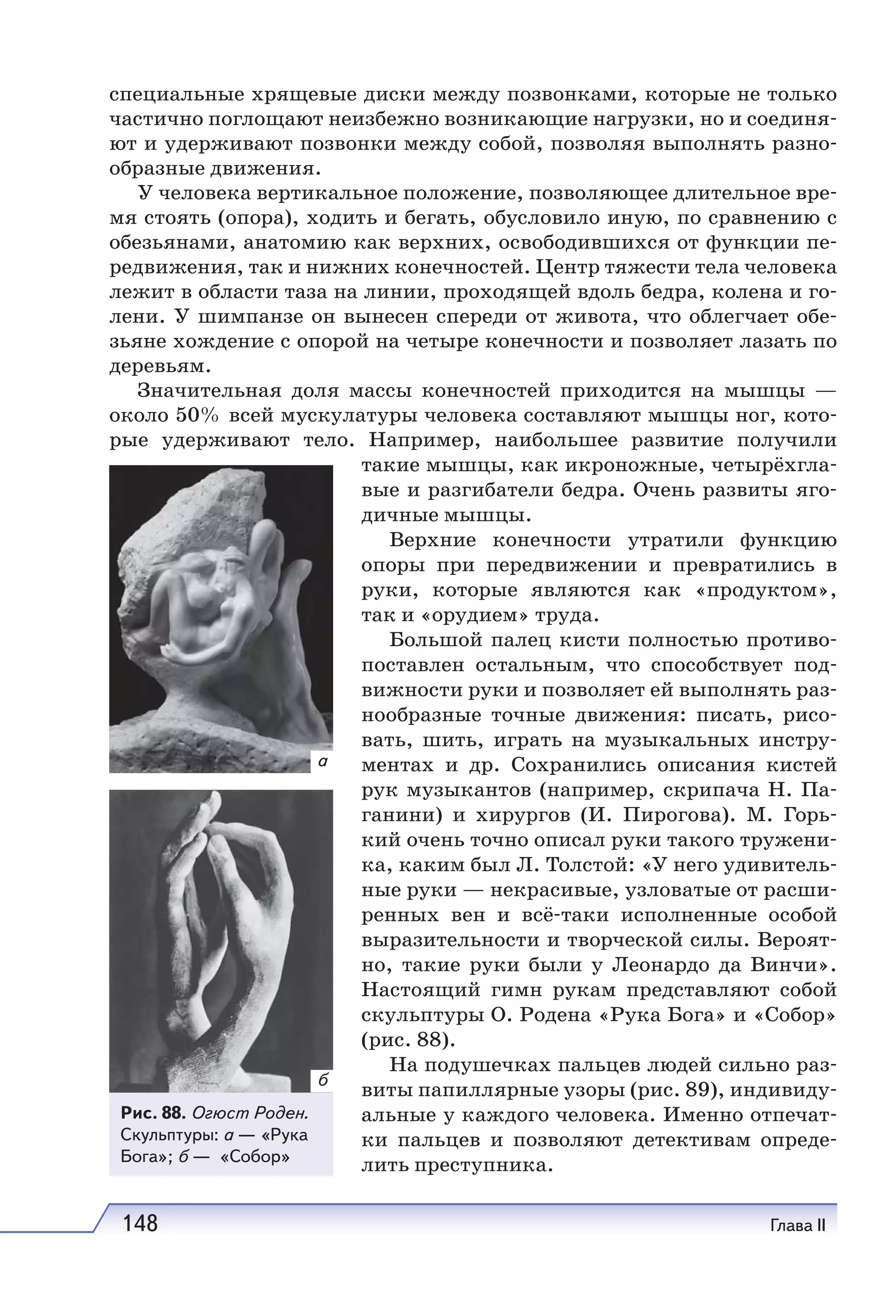
Учебник по естествознанию для 11 классов охватывает современные научные представления и включает разделы о структуре атома, здоровье человека и природных явлениях. Он соответствует требованиям ФГОС и включает задания и методические рекомендации для исследовательских работ. Учебник получил положительное заключение от Российской академии наук и образования.

![УДК 373.167.1:501
ББК 20я72
Г12
Габриелян, О. С.
Естествознание. Базовый уровень. 11 кл. : учебник / О. С. Габри-
елян, И. Г. Остроумов, Н. С. Пурышева, С. А. Сладков, В. И. Си-
воглазов. — М. : Дрофа, 2013. — 334, [2] с. : ил.
ISBN 978-5-358-10769-4
Учебник предназначен учащимся 11 классов гуманитарного, социально-эконо-
мического, информационно-технологического профиля и является продолжением
курса «Естествознание» для 10 класса тех же авторов.
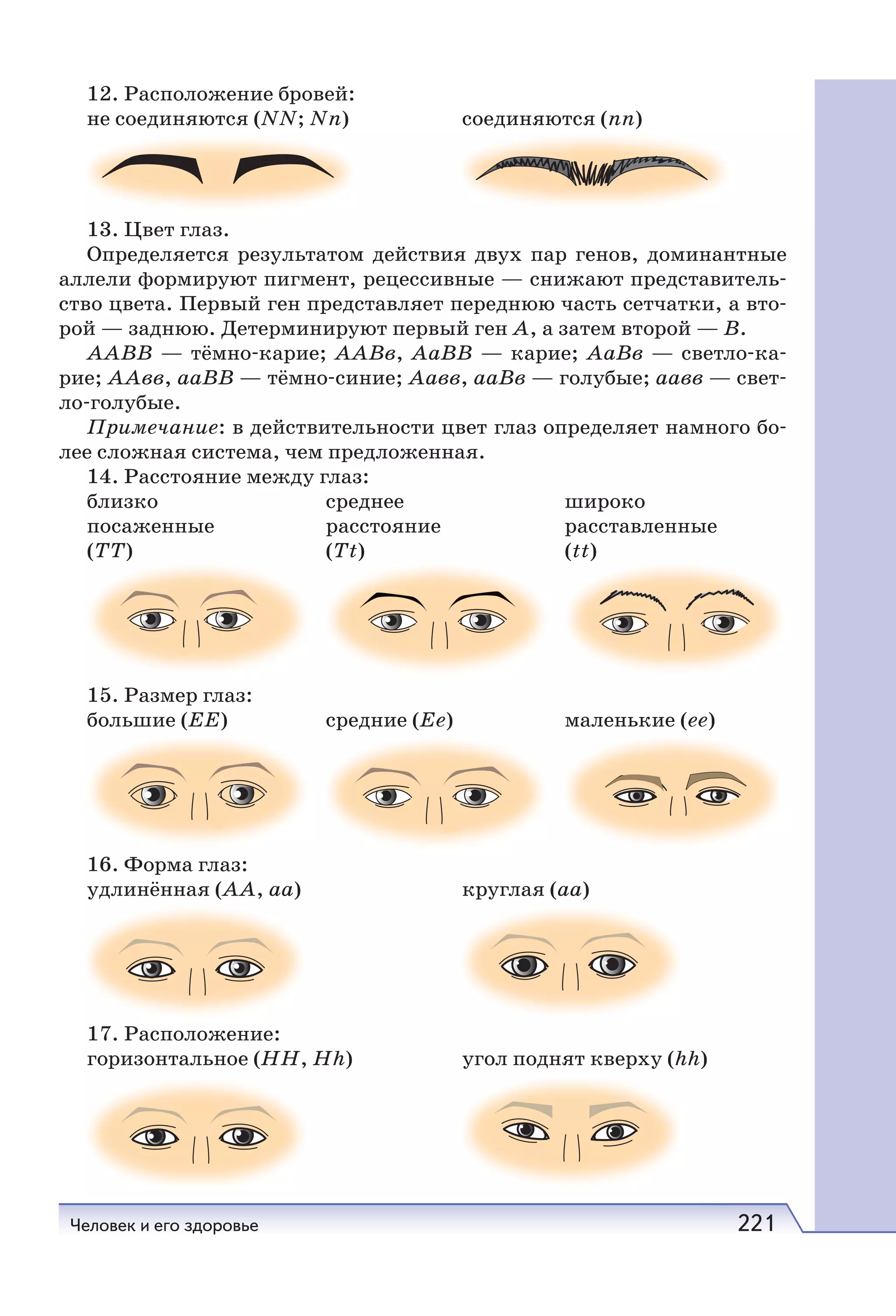
Учебник по новому учебному курсу «Естествознание» создан с учетом совре-
менных научных представлений, соответствует требованиям, заявленным в ФГОС,
и включает разделы «Микромир. Атомы. Вещества. Реакции», «Человек и его здо-
ровье», «Естествознание на службе человека».
В конце каждого параграфа даны результаты его изучения, темы рефератов,
задания, позволяющие применить полученные знания. Каждая глава завершается
методическими рекомендациями по проведению исследовательских работ. Таким
образом, содержание учебника полностью реализует требования ФГОС среднего
(полного) общего образования.
УДК 373.167.1:501
ББК 20я72
Г12
ISBN 978-5-358-10769-4 © ООО «ДРОФА», 2013
Учебник получил положительное заключение
Российской академии наук (№ 10106-5215/162 от 12.10.2012 г.)
и Российской академии образования (№ 01-5/7д-443 от 11.10.2012 г.)](https://image.slidesharecdn.com/11eg-160302015112/75/11-e-g-2-2048.jpg)


















![Микромир. Атомы. Вещества. Реакции 23
Так как катионы образуют преимуществен-
но атомы металлов, а анионы — только атомы
неметаллов, то логично сделать вывод, что
этот тип связи характерен для соединений,
образованных типичными металлами (ще-
лочными и щёлочноземельными) и типич-
ными неметаллами (галогенами, кислоро-
дом). Классическим примером веществ с ион-
ной связью являются галогениды и оксиды
щелочных и щёлочноземельных металлов
(рис. 7).
Схему образования ионной связи между
атомами натрия и хлора можно представить
так:
Na + Cl Na+[ Cl ]–.
ИОННЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ. Два разноимённо заряженных
иона, связанных силами взаимного притяжения, взаимодействуют и с
другими противоположно заряженными ионами. В результате образу-
ются кристаллические соединения, характеризующиеся правильным
расположением тех частиц (в рассматриваемом примере — ионов), из
которых они состоят, в строго определённых точках пространства.
При соединении этих точек прямыми линиями образуется прост-
ранственный каркас, который называют кристаллической решёт-
кой. Точки, в которых размещены частицы кристалла, называют
узлами решётки.
Вещества с ионным типом связи имеют ионные кристаллические
решётки (рис. 8). Такие соединения представляют собой твёрдые,
прочные, нелетучие вещества с высокими
температурами плавления. При обычных
условиях кристаллы таких веществ электри-
ческого тока не проводят, а растворы и рас-
плавы большинства ионных соединений пред-
ставляют собой прекрасные электролиты.
Вещества с ионными кристаллическими
решётками хрупки. Если попытаться дефор-
мировать такую кристаллическую решётку,
один из слоёв её будет двигаться относительно
другого до тех пор, пока одинаково заряжен-
ные ионы не окажутся друг против друга. Эти
ионы сразу начнут отталкиваться, и решётка
разрушится. Отсюда и хрупкость ионных со-
единений.
Рис. 7. Схема обра-
зования ионной связи
между атомами кальция
и кислорода
Рис. 8. Ионная кри-
сталлическая решётка
хлорида натрия (каждый
ион хлора окружён шес-
тью ионами натрия)](https://image.slidesharecdn.com/11eg-160302015112/75/11-e-g-23-2048.jpg)