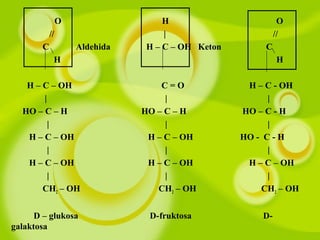
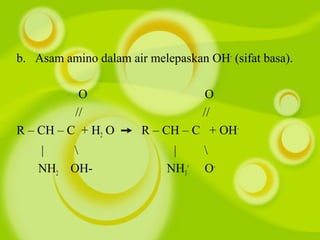
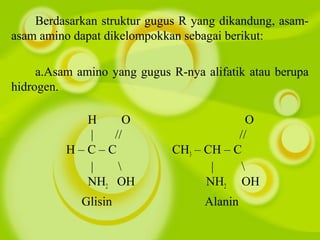
Dokumen ini membahas kompetensi dalam memahami senyawa dan reaksi polimer, termasuk struktur, penggolongan, dan sifat makromolekul seperti polimer alami dan sintetis. Siswa diajarkan tentang reaksi pembentukan polimer, baik adisi maupun kondensasi, serta sifat fisik dan dampaknya terhadap lingkungan. Berbagai contoh polimer seperti PVC, nilon, dan karet disertakan untuk menjelaskan kegunaan dan proses pembuatan mereka.















![3. Pembentukan bakelit dari fenol dan metanal (formaldehid).
OH H H
| /
C
fenol | |
O
metanal (formaldehid)
Polimerisasi kondensasi bakelit:
H2O H2O H2O
↑ ↑ ↑
...O + H - OH - H + O + H - - H + ...
| | | |
C fenol C
// //
H H H↓H
Metanal OH
|
[ - H2C - - CH2 -]n Bakelit](https://image.slidesharecdn.com/polimerpowpoint-130719214012-phpapp01/85/Polimer-pow-point-16-320.jpg)
![4. Pembentukan urea-metanal dari urea dan metanal.
Reaksinya: H2N – CO – NH2 HCHO
Urea metanal (formaldehid)
Polimerisasi kondensasi urea-metanal:
H2O H2O H2O
↑ ↑ ↑
...O + H - N – CO - N - H + O + H - N – CO - N - H + ...
| | | | | | | |
CH2 H urea H CH2 H H
↓ metanal
[- CH2 - NH CO – NH - CH2 – NH – CO – NH -]n
Urea-Metanal](https://image.slidesharecdn.com/polimerpowpoint-130719214012-phpapp01/85/Polimer-pow-point-17-320.jpg)