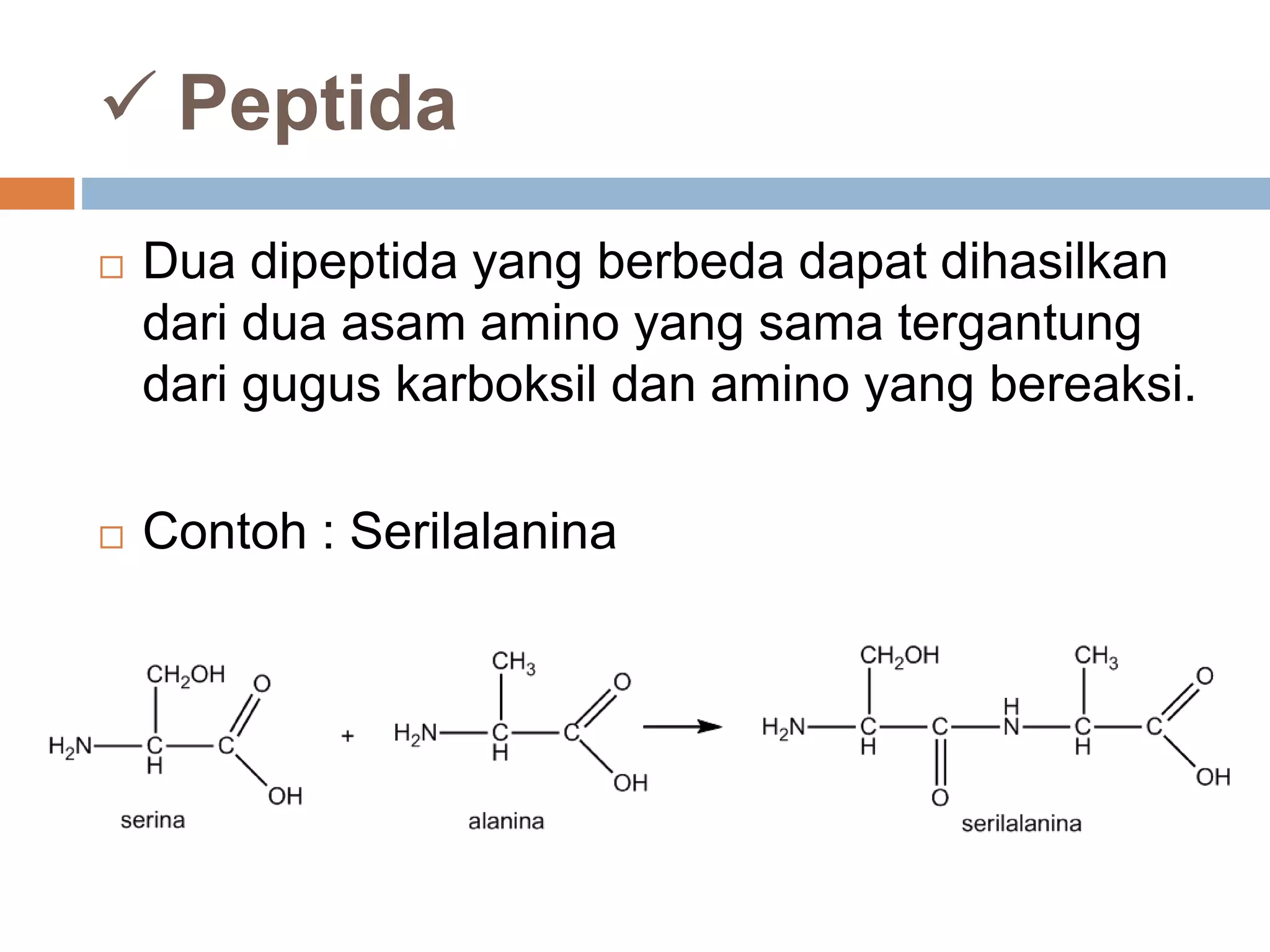
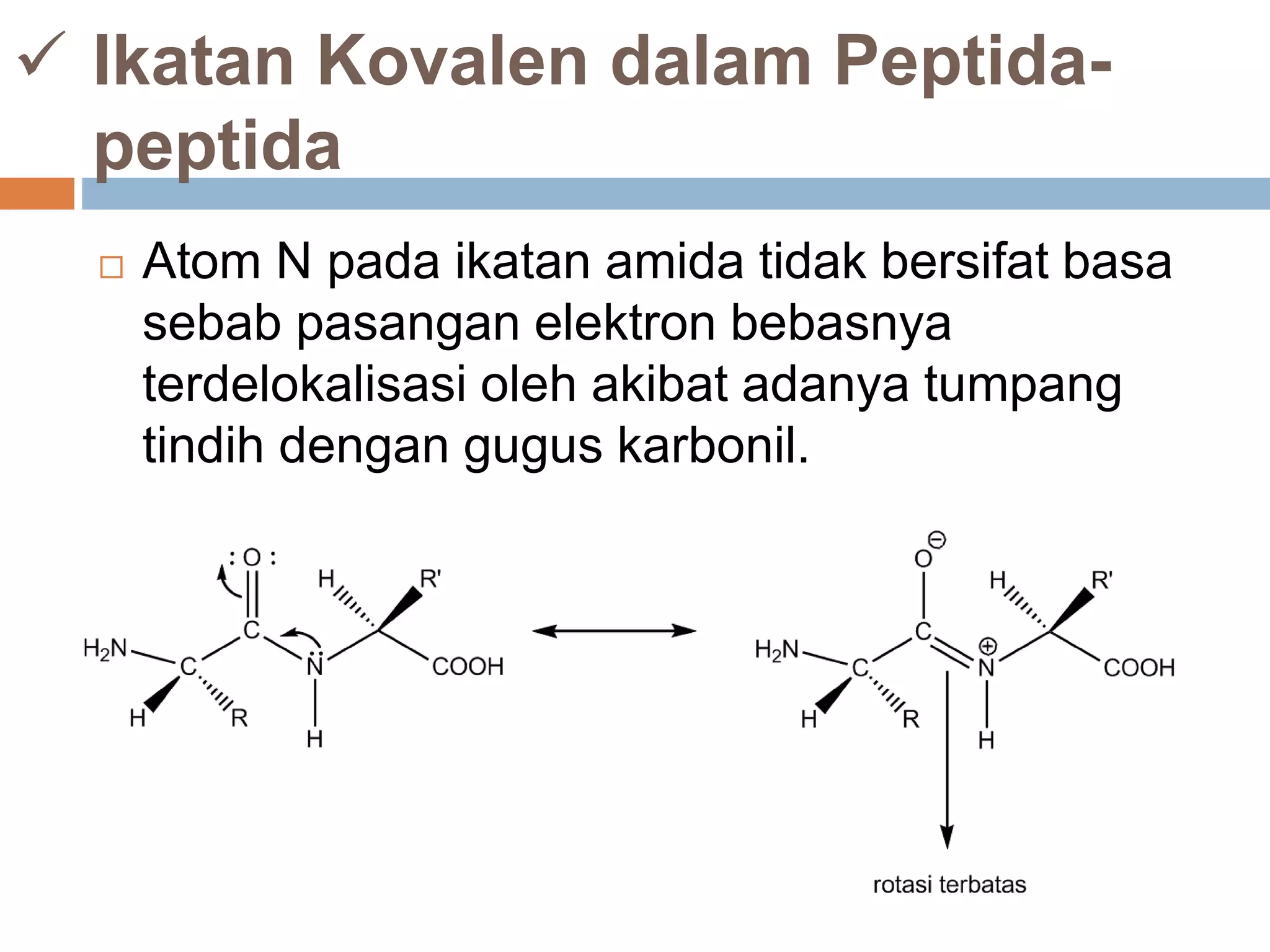
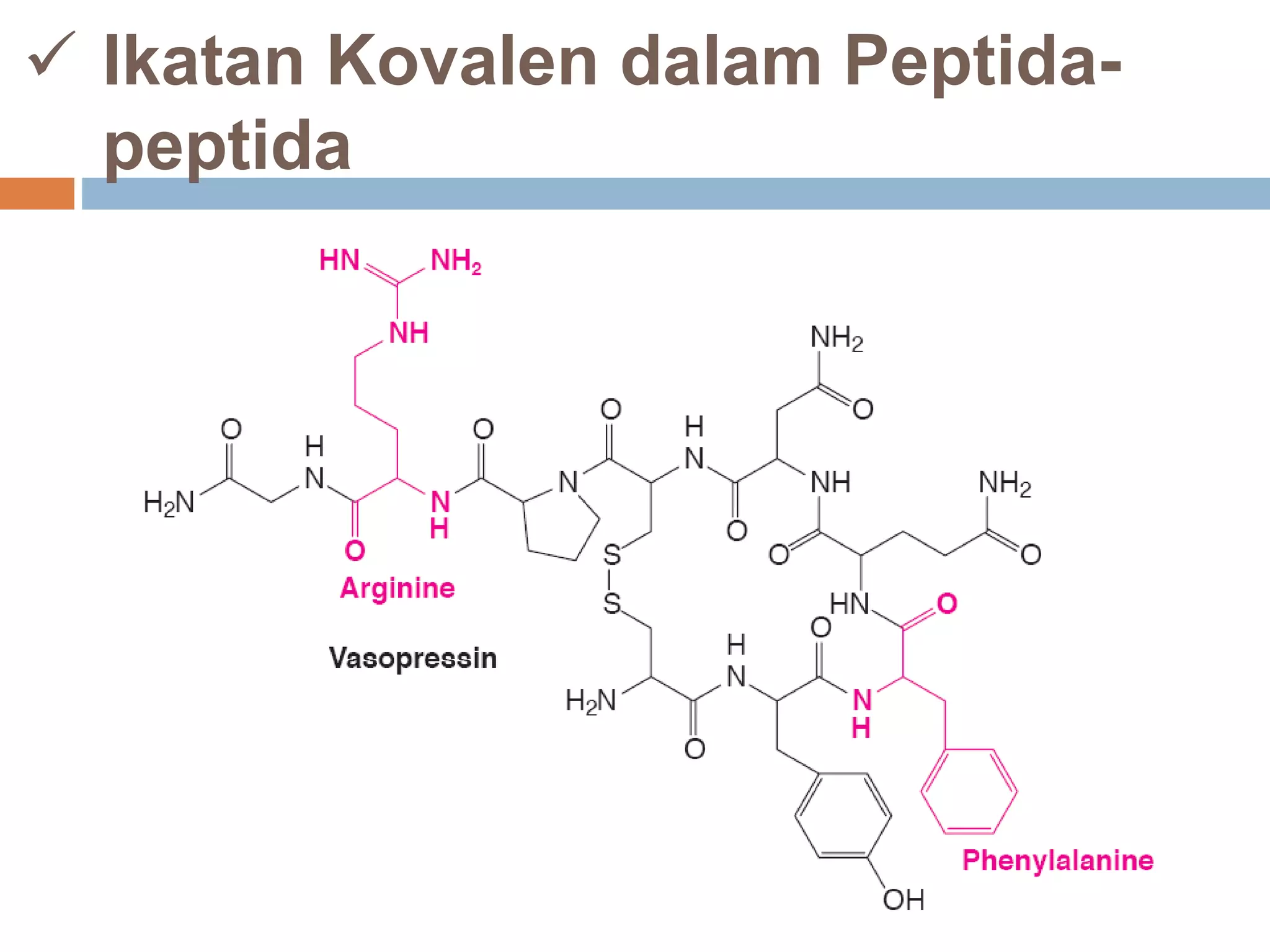
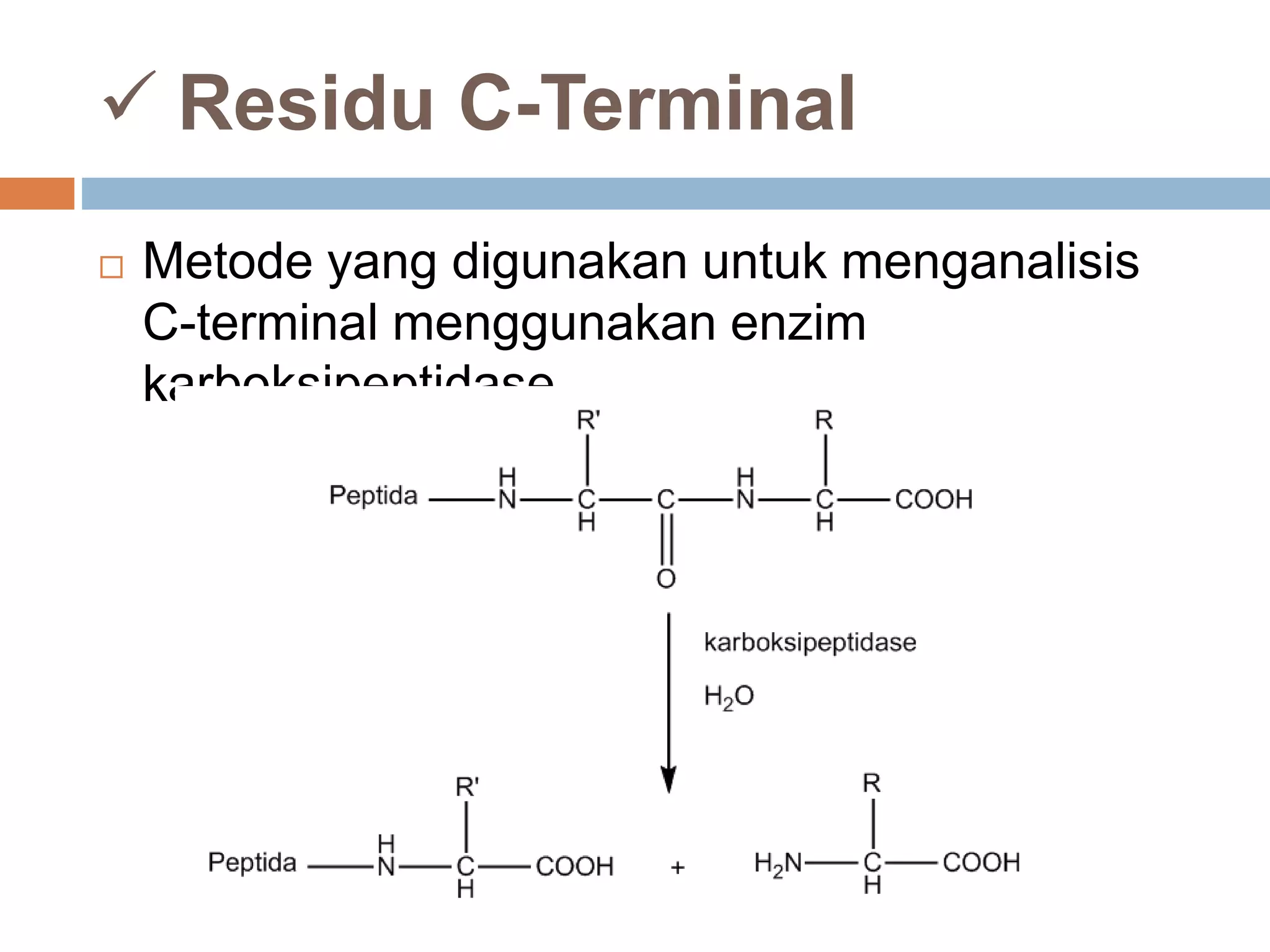
Dokumen ini membahas tentang peptida, termasuk struktur, ikatan peptida, dan metode analisis asam amino. Penentuan urutan asam amino dalam peptida dijelaskan melalui degradasi Edman dan analisis n-terminal Sanger. Metode analisis meliputi penggunaan kromatografi dan enzim untuk mendapatkan informasi tentang asam amino yang menyusun peptida.