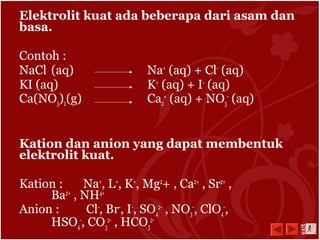
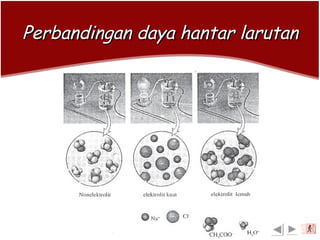
Dokumen ini menjelaskan tentang larutan elektrolit dan non-elektrolit, termasuk definisi dan perbedaannya berdasarkan daya hantar listrik. Larutan elektrolit terbagi menjadi elektrolit kuat dan lemah, sementara larutan non-elektrolit tidak dapat menghantarkan arus listrik. Penjelasan juga mencakup sifat-sifat dan reaksi ionisasi dari masing-masing jenis larutan.