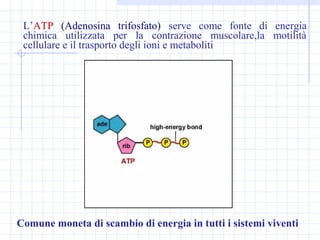
Le proprietà dei composti organici dipendono dalla loro struttura e dai gruppi funzionali, che sono polari e solubili in acqua. La documentazione esplora reazioni chimiche, distinguendo fra reazioni esasperanti ed energiche e spiegando la regolazione del pH in relazione alla crescita cellulare e all'acidificazione delle sostanze. Viene trattata anche la distinzione tra acidi e basi con riferimenti a teorie chimiche, caratteristiche e esempi nella vita quotidiana.




















![L’acqua quindi si può comportare da
acido o da base in quanto può dare
[H+
] o [OH-
]
Quindi è una sostanza
ANFOTERA](https://image.slidesharecdn.com/ii-lezione-1290010556-phpapp02/85/I-I-Lezione-22-320.jpg)