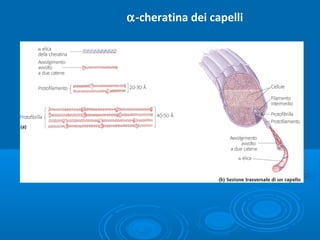
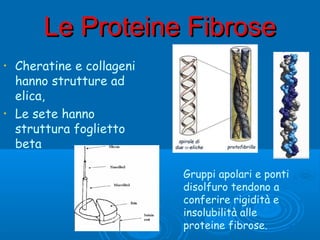
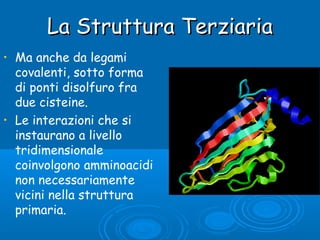
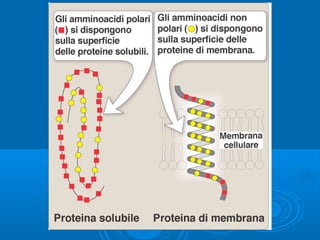
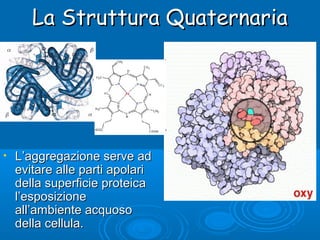
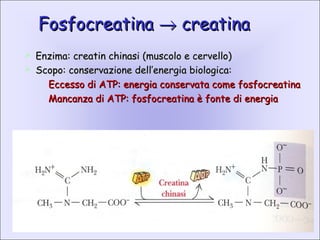
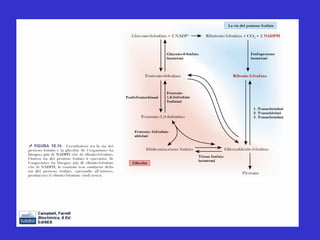
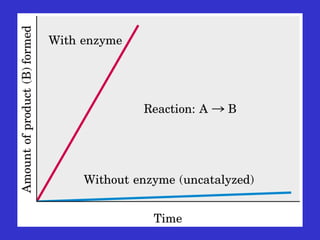
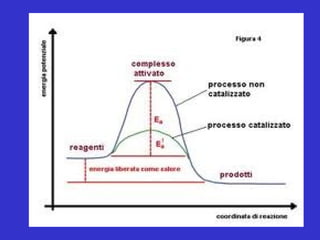
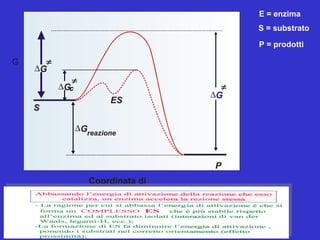
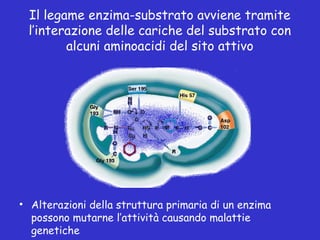
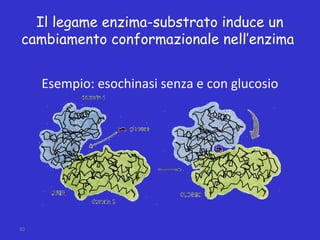
Il documento tratta la classificazione delle proteine in fibrose e globulari, evidenziando le loro differenze strutturali e funzionali. Le proteine fibrose, come cheratine e collagene, svolgono ruoli strutturali, mentre le proteine globulari, come enzimi e ormoni, sono più solubili e partecipano a funzioni biologiche. Inoltre, vengono analizzate le strutture terziarie e quaternarie delle proteine, oltre alla digestione delle proteine e al ruolo degli enzimi nel metabolismo.