More Related Content
What's hot
PDF
PDF
PPT
PPT
PPT
PPS
PDF
PPT
PDF
PDF
PDF
DOC
PDF
PDF
วิชาเคมี ม.ปลาย เรื่องตารางธาตุ PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium PPT
PDF
PDF
PDF
Similar to ไฟฟ้าเคมี
PDF
PPT
PDF
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี PPT
PPT
PDF
เคมีไฟฟ้า (Electrochemistry) PDF
กระบวนการอิเล็กโทรลิซิส (Electrolysis Chemistry) PDF
PDF
DOC
โจทย์อัตราการเกิดปฎิกิริยาเคมี DOC
DOC
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย DOC
PDF
PDF
PPT
PDF
DOC
โจทย์อัตราการเกิดปฏิกิริยาเคมี ไฟฟ้าเคมี
- 1.
1
ไฟฟ้าเคมี (ElectroChemistry)
ไฟฟ้าเคมี เป็นการศึกษาเกี่ยวกับปฏิกิริยาเคมีที่ทำาให้เกิด
กระแสไฟฟ้า กระแสไฟฟ้าทำา ให้เกิดปฏิกิริยาเคมีหากใช้การ
ถ่ า ยเทอิ เ ล็ ก ตรอนเป็ น เกณฑ์ แ ล้ ว ปฏิ กิ ริ ย าเคมี แ บ่ ง เป็ น 2
ประเภท
1. ปฏิ กิ ริ ย าที่ มี ก ารถ่ า ยเท e- เรี ย กว่ า ปฏิ กิ ริ ย ารี ด อกซ์
(Redox Reaction)
2. ปฏิกิริยาที่ไม่มีการถ่ายเท e- เรียกว่าปฏิกิริยานอนรี
ดอกซ์ (Nonredox Reaction)
ป ฏิ กิ ริ ย า รี ด อ ก ซ์ (Redox Reaction ห รื อ Oxidation-
reduction Reaction)
ปฏิ กิ ริ ย ารี ด อกซ์ หมายถึ ง ปฏิ กิ ริ ย าที่ เ กี่ ย วกั บ การ
ถ่ายเท e-
ตั ว อ ย่ า ง เ มื่ อ นำา แ ผ่ น โ ล ห ะ ท อ ง แ ด ง (Cu) จุ่ ม ล ง ใ น
สารละลายของ AgNO3 พบว่าที่แผ่นโลหะ Cu มีของแข็งสีขาว
ปนเทามาเกาะอยู่ และเมื่อนำา มาเคาะจะพบว่าโลหะ Cu เกิดการ
สึกกร่อน ส่ว นสี ของสารละลาย AgNO3 ก็จะเปลี่ย นจากใสไม่มี สี
เป็นสีฟ้า
การเปลี่ยนแปลงที่เกิดขึ้นนี้อธิบายได้ว่าการที่โลหะทองแดง
เกิ ด การสึ ก กร่ อ นเป็ น เพราะโลหะทองแดง(Cu) เกิ ด การเสี ย
อิเล็กตรอนกลายเป็น Cu2+ ซึ่งมีสีฟ้าและเมื่อ Ag+ รับอิเล็กตรอน
เข้ า มาจะกลายเป็ น Ag (โลหะเงิ น ) มาเกาะอยู่ ที่ แ ผ่ น โลหะ
ทองแดง
ปฏิกิริยาที่เกิดขึ้น เขียนในรูปสมการได้ดังนี้
Cu(s) Cu2+(aq) + 2 e- (ปฏิกิริยา
ออกซิเดชัน)
Ag+(aq) + e- Ag(s) (ปฏิกิริยา
รีดักชัน)
e- ที่ถ่ายเทต้องเท่ากัน สมการเคมีที่เกิดขึ้นที่แท้จริง
ต้องเป็น
Cu(s) Cu 2+(aq) + 2 e- (
ปฏิกิริยาออกซิเดชัน)
2Ag+(aq) +2 e- 2Ag(s) (ปฏิกิริยา
รีดักชัน)
- 2.
2
ปฏิกิริยาที่เกิดขึ้นในแต่ละสมการเรียกว่าครึ่งปฏิกิริยา ซึงการ่
เกิดปฏิกิริยาถ่ายเท e- จะเกิดขึ้นได้สมบูรณ์ก็ต่อเมื่อต้องนำา ครึ่ง
ปฏิกิริยาทั้งสองมารวมกัน เขียนเป็นสมการได้ดังนี้
Cu(s) + Ag+(aq) Cu2+(aq) +
2Ag(s) (ปฏิกิริยารีดอกซ์)
สรุปได้วาการเกิดปฏิกิริยารีดอกซ์จะต้องประกอบไปด้วย
่
1. สารที่ ใ ห้ e- เรี ย กว่ า ตั ว รี ดิ ว ซ์ เกิ ด ปฏิ กิ ริ ย า
ออกซิเดชัน (Oxidation Reaction)
2. สารที่รับ e- เรียกว่าตัวออกซิไดซ์ เกิดปฏิกิริยา
รีดักชัน (Reduction Reaction)
เซลล์ไฟฟ้าเคมี
เนื่องจากการที่ สารที่ใ ห้ e- และสารที่รั บ e- สัม ผัส กัน
โดยตรง จะไม่สามารถแสดงกระแสไฟฟ้าที่เกิดขึ้นได้ ดังนั้นหาก
ต้องการให้มีกระแสไฟฟ้าเกิดขึ้นต้องมีการนำา ลวดตัวนำา ไฟฟ้าต่อ
เชื่อมเข้าไประหว่างขั้วไฟฟ้าของครึ่งเซลล์ที่ให้ e- และครึ่งเซลล์
ที่รับ e- และพร้อมกับโวลต์มิเตอร์ และสะพานเกลือเชื่อมระหว่าง
ครึ่งเซลล์ทั้งสอง
ขั้วไฟฟ้า e- ® e- ® ขัวไฟฟ้า
้
เช่น เซลล์
ไฟฟ้าเคมี
e-
e- ขั้ว ขั้ว
ไฟฟ้ ไฟฟ้
Cu สะพานเกลือ
Ag
Cu2 Ag
+ +
Cu Cu2+ + 2 e-
Ag+ + e- Ag
- 3.
3
ค รึ่ ง เ ซ ล ล์ Oxidation
Reduction
ขั้ ว ไ ฟ ฟ้ า ล บ (อ า โ น ด )
บวก (คาโทด)
ปฏิกิริยาที่เกิดขึ้น Cu(s) + 2Ag+(aq) Cu2+
(aq) + 2Ag(s)
แผนภาพเซลล์ไฟฟ้าเคมี
หากปฏิกิริยารีดอกซ์ที่เกิดขึ้นเป็น A(s) + B+(aq)
+
A (aq) + B(s)
แผนภาพเซลล์ไฟฟ้าเคมี A(s) | A+(aq)
|| B+(aq) | B(s)
ครึ่ง
เซลล์ออกซิเดชัน ครึ่งเซลล์รีดักชัน
หมายเหตุ 1. | | แทนสะพานเกลือ และแต่ละครึ่งเซลล์
ให้ใช้เครื่องหมาย | คั่นระหว่างสารต่าง
สถานะ
2. หากต้ อ งการระบุ ค วามเข้ ม ข้ น ให้ เ ขี ย นไว้ ใ น
วงเล็บแล้ววางหลังสารละลาย
เช่ น Cu(s) | Cu2+(aq)(0.1M) | | Ag+
(aq)(0.1M) | Ag(s)
3. หากสารในสถานะเดียวกันมีมากกว่า 1 ชนิด ให้
ใช้เครื่องจุลภาค ( , ) คั่น
เช่ น Fe(s) | Fe2+(aq) , Fe3+(aq) | |
Cu2+(aq) | Cu(s)
4. หากมีความดันเกี่ยวข้อง ให้ระบุความดัน
ในวงเล็บ แล้ววางหลังก๊าซนั้น
เช่ น Pt(s) | H2(atm) | H+(aq) | | Ag+
(aq) | Ag(s)
ศักย์ไฟฟ้ามาตรฐาน (E°)
ครึ่งเซลล์มาตรฐานที่ใช้เปรียบเทียบความสามารถในการให้
รับ e- ของครึ่งเซลล์ต่างๆ จะใช้ครึ่งเซลล์ไฮโดรเจนเขียนแทน
- 4.
4
ด้ ว ยPt(s) | H2(1atm) | H+(1M) และกำา หนดให้ ค่ า ศั ก ย์ ไ ฟฟ้ า
ของไฮโดรเจนที่สภาวะมาตรฐาน(25°C,1atm) มีค่าเท่ากับศู นย์
โวลต
Eo H2 = 0.00 Volt
การวัดค่า ศักย์ไ ฟฟ้ ามาตรฐาน ของเซลล์ไ ฟฟ้า ใดๆ ทำา ได้
โดยการนำา ครึ่งเซลล์มาตรฐานไฮโดรเจนต่อกับครึ่งเซลล์ที่สนใจ
และขั้วไฟฟ้าจะต้องจุ่มอยูในสารละลายเข้มข้น 1 Molar โดย
่
E°Cell = E°คาโทด - E°อาโนด
ข้อควรทราบเกี่ยวกับค่า E°
1. ถ้ามีการกลับสมการ ค่า E° จะเท่าเดิม แต่
เครื่องหมายตรงกันข้าม
2. ถ้ามีการคูณสมการด้วยตัวเลขใดๆ ค่า E° จะ
เท่าเดิม ไม่เปลี่ยนแปลง
3. ค่ า E°reduction ยิ่ ง มาก แสดงว่ า สารนั้ น ยิ่ ง รั บ e-
ได้ดี (แนวโน้มความเป็นตัวออกซิ
ไดซ์มากขึ้น)
ค่ า E°reduction ยิ่ ง ตำ่า แสดงว่ า สารนั้ น ยิ่ ง ให้ e-
ได้ดี (แนวโน้มความเป็นตัวรีดิวซ์
มากขึ้น)
โดยทั่ ว ไปเมื่ อ กล่ า วถึ ง E° หากไม่ มี ก ารระบุ ว่ า เป็ น E
°reduction หรือ E°oxidation ให้ถือว่าเป็น E°reduction
ประโยชน์ของค่า E°reduction
1. ใช้เปรียบเทียบความสามารถในการเป็นตัวรีดิวซ์และตัว
ออกซิไดซ์
Ä สารที่ให้ e- ได้ดี E° ตำ่า , สารที่รับ e- ได้ดี E°
สูง
เ ช่ น Zn2+(aq) + 2 e-
Zn(s) E° = - 0.76 Volt
Ag+(aq) + e- Ag(s)
E° = 0.80 Volt
พิ จ ารณา Eo Zn2+
< Eo Ag+
ตัวรีดิวซ์ : Zn > Ag
- 5.
5
ตัวออกซิไดซ์ : Ag+ > Zn2+
2. ใช้คำานวณค่าศักย์ไฟฟ้าของเซลล์และครึ่งเซลล์
อาศัยหลัก E°Cell = E°คาโนด - E°อา
โนด E°
= E°ขัวบวก - E°ขัวลบ
้ ้
= E°สูง - E°ตำ่า
ประโยชน์ของค่า E°Cell
E°Cell > 0 ปฏิกิริยาเกิดได้
E°Cell < 0 ปฏิกิริยา
เกิดไม่ได้ (เกิดในทิศตรงข้าม)
E°Cell = 0 ปฏิกิริยาเกิดไม่
ได้แน่นอน
ตัวอย่างการคำานวณศักย์ไฟฟ้าของครึ่งเซลล์
EX. เมื่ อนำา ครึ่ ง เซลล์ ข อง Ag | Ag+ ต่ อ กั บ ครึ่ ง เซลล์
ของ Pt | H2 | H+ พบว่าเข็มของโวลต์มิเตอร์เบนหาขั้ว Ag และ
อ่ า น ค่ า ไ ด้ 0.80 Volt ใ ห้ ห า ค่ า E° ข อ ง Ag+ + e-
Ag
วิธีทำา จากการที่เข็มโวลต์เบนเข้าหาขั้ว Ag
แสดงว่า Ag | Ag+ รับ e-
Pt | H2 | H+ ให้ e-
จาก E°Cell = E°คาโทด - E°อาโนด
0.80 = E Ag - Eo H2
o
0.80 = Eo Ag – 0
ดังนั้น Eo Ag = 0.80 Volt
นั่นหมายความว่า Ag + e-
+
Ag E
° = 0.80 Volt #
ตัวอย่างการคำานวณศักย์ไฟฟ้าของเซลล์
EX. เมื่ อ นำา ครึ่ ง เซลล์ ข อง Fe | Fe2+ ต่ อ เข้ า กั บ Ni |
Ni2+ ให้หาค่า E°Cell
กำา หนด Fe2+ + 2 e- Fe E°
= - 0.41 Volt
Ni2+ + 2 e- Ni E° =
- 0.23 Volt
- 6.
6
วิธีทำา E°Cell = E°สูง - E° ตำ่า = - 0.23 -
( - 0.41)
= 0.18 Volt
#
อิเล็กโตรลิซิส (Electrolysis)
ป ฏิ กิ ริ ย า ใ ด ที่ เ กิ ด ขึ้ น ไ ม่ ไ ด้ เ ช่ น Cu(s) + Zn+(aq)
Cu2+(aq) + Zn(s) หากต้ อ งการทำา ให้ เ กิ ด ปฏิ กิ ริ ย าก็ ส ามารถ
ทำา ได้โดยผ่านพลังงานไฟฟ้าจากภายนอก ซึ่งปฏิกิริยาที่ได้จาก
การแยกสลายด้ ว ยด้ ว ยไฟฟ้ า นี้ มี ชื่ อ เรี ยกว่ า อิ เล็ กโ ตร ลิ ซิ ส
(Electrolysis)
ส่วนประกอบที่สำาคัญของ Electrolytic Cell
1. แหล่งพลังงานไฟฟ้าจากภายนอก
2. ขั้วไฟฟ้า
3. สารละลายอิเล็กโตรไลท์
ลักษณะการเกิดปฏิกิริยาเป็นดังนี้
ส า ร ที่ ใ ห้ e- แ ก่ ขั้ ว บ ว ก เ กิ ด ป ฏิ กิ ริ ย า Oxidation
ขั้วอาโนด -
สารที่ รั บ e- จากขั้ ว ลบ เกิ ด ปฏิ กิ ริ ย า Reduction
ขั้วคาโทด +
การดุลสมการรีดอกซ์
ต้องผ่านขั้นตอนการหาเลขออกซิเดชัน
1.โดยเลขออกซิเดชันจะหมายถึงตัวเลขแสดงค่าประจุไฟฟ้า
ทีแท้จริงหรือประจุไฟฟ้าสมมติของธาตุ
่
เกณฑ์การกำาหนดค่าเลขออกซิเดชัน (O.N.)
1. ธาตุอิสระ (ไม่รวมตัวกับธาตุอื่น มีค่า O.N. = ศูนย์)
เช่น Mg , O2 , O3 , S8 , P4
2. ธาตุหมู่ 1 ในสารประกอบ มีค่า O.N. = 1
เช่น LiNo3 , NaCl , KclO3
3. ธาตุหมู่ 2 ในสารประกอบ มีค่า O.N. = 2
เช่น MgCl2 , CaCO3 , BeCl2
4. ธาตุไฮโดรเจน ในสารประกอบ มีค่า O.N. = 1
เช่น HCl , NH3 , H2O
- 7.
7
ยกเว้น ในสารประกอบของโลหะ เช่น NaH ,
AlH3 H มี O.N. = -1
5. ธาตุออกซิเจน ในสารประกอบ มีค่า O.N. = - 2
เช่น H2O , CO2 , C2O
ยกเว้ น H2O2 , Na2 O , NaO2 , OF O มี
O.N. = -2
6. ผลรวมของ O.N. ในสารประกอบมีค่าเป็นศูนย์
เช่น KmnO4 , MnO2 , Na2C2O4
7. ผลรวมของ O.N. ในไอออนเท่ากับจำานวนประจุ
เช่น MnO4- , Cr2O72-, Fe(CN)63-
Note ไ อ อ อ น ที่ ค ว ร จำา SO42- , CN- , CO32- , NO3-
ไอออนที่มี O.N. เท่ากับจำานวนประจุ
ตัวอย่างการหาเลขออกซิเดชันของธาตุ
Mn2O7 2Mn + 7O = 0
Na3PO4 3Na + P + 4O = 0
2Mn + 7(-2) = 0
3(1) + P + 4(-2) = 0
2Mn = 14
3+P–8 = 0
Mn = +7 #
P = +5 #
MnSO4 Mn + SO4 = 0 C 2O42-
2C + 4O = -2
Mn + (-2) = 0
2C + 4(-2) = -2
Mn = +2 #
2C = 6
C
= +3 #
ขั้นตอนการดุลสมการรีดอกซ์
1. หาธาตุที่มี O.N. เปลียนไป ต่อ 1 อะตอมของธาตุ
่
- 8.
8
2. นำา เลข O.N. ที่เปลี่ยนไปมาคูณไขว้ (เพื่อให้จำา นวน
e- ทีถายเทเท่ากัน)
่ ่
3. ดุลอะตอมของธาตุ (H กับ O ทำาทีหลัง)
4. ถ้าทอนได้ให้ทอนเป็นอัตราส่วนอย่างตำ่าด้วย
ตัวอย่างการดุลสมการรีดอกซ์
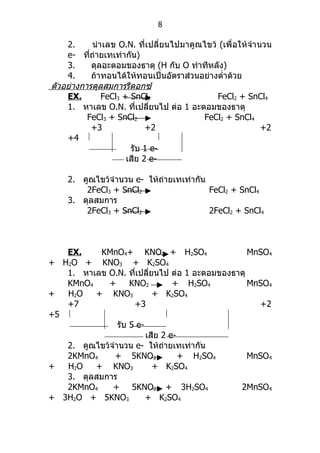
EX. FeCl3 + SnCl2 FeCl2 + SnCl4
1. หาเลข O.N. ทีเปลียนไป ต่อ 1 อะตอมของธาตุ
่ ่
FeCl3 + SnCl2 FeCl2 + SnCl4
+3 +2 +2
+4
รับ 1 e-
เสีย 2 e-
2. คูณไขว้จำานวน e- ให้ถายเทเท่ากัน
่
2FeCl3 + SnCl2 FeCl2 + SnCl4
3. ดุลสมการ
2FeCl3 + SnCl2 2FeCl2 + SnCl4
EX. KMnO4+ KNO2 + H2SO4 MnSO4
+ H2O + KNO3 + K2SO4
1. หาเลข O.N. ทีเปลียนไป ต่อ 1 อะตอมของธาตุ
่ ่
KMnO4 + KNO2 + H2SO4 MnSO4
+ H2O + KNO3 + K2SO4
+7 +3 +2
+5
รับ 5 e-
เสีย 2 e-
2. คูณไขว้จำานวน e- ให้ถายเทเท่ากัน
่
2KMnO4 + 5KNO2 + H2SO4 MnSO4
+ H2O + KNO3 + K2SO4
3. ดุลสมการ
2KMnO4 + 5KNO2 + 3H2SO4 2MnSO4
+ 3H2O + 5KNO3 + K2SO4
- 9.
9
การดุลสมการรีดอกซ์แบบครึ่งปฏิกิริยา
ทำาตามขั้นตอนดังนี้
1. ในสารละลายกรด
EX. Fe2+ + Cr2O72- Fe3+ + Cr3+
วิธีทำา 1. แยกครึ่งปฏิกิริยา
Fe 2+
Fe 3+ Cr 2O72-
Cr3+
2. ดุลอะตอม
Fe2+ Fe 3+ Cr 2O72-
2Cr3+
เติ ม H2O ด้ า นขาดออกซิ เ จน
เท่ากับจำานวนที่ขาดออกซิเจน
Cr2O72- 2Cr3+ +
7H2O
เติ ม H+ ด้ า นขาดไฮโดรเจน
เท่ากับจำานวนที่ขาดไฮโดรเจน
Cr2O72-- + 14H+
2Cr3+ + 7H2O
3. ดุลประจุ (โดยการเติม e- )
จาก Fe2+ Fe 3+ + e-
จำานวนประจุเท่ากันคือ 2
Cr2O72- + 14H+ + 6 e- 2Cr3+ + 7H2O
จำานวนประจุเท่ากันคือ 6
4. ทำา การถ่ า ยเท e- ให้ เ ท่ า กั น (โดยการคู ณ ไขว้
จำานวน e- )
6Fe2+ 6Fe3+ + 6 e-
Cr2O72- + 14H+ + 6 e- 2Cr3+ + 7H2O
5. รวมสมการ
6Fe + Cr2O72- + 14H+
2+
6Fe 3+ +
2Cr3+ + 7H2O
2. ในสารละลายเบส
EX. I- + MnO4- ® I2 + MnO2
วิธีทำา แยกครึ่งปฏิกิริยา
- 10.
10
I- I2 ดุ ล อ ะ ต อ ม
MnO4 -
MnO2
2I -
I2 ดุ ล ป ร ะ จุ
อะตอมของ Mn ดุลแล้ว
2I- I2 + 2 e- ∴ ดุล
O โดยเติม H2O ด้านขาด O เท่ากับ
จำานวนที่ขาด O2
MnO44- MnO2 + 2H2O
เติม H+ ด้านขาด H เท่ากับจำานวนที่ขาด H
MnO44- MnO2 + 2H2O
สารละลายเบสห้ามมีกรด ดังนั้นต้องเติม OH- ทั้ง 2
ด้าน
MnO4- + 4H+ + 4OH- MnO2 + 2H2O +
4OH -
H+ + OH- H2O ดั ง นั้ น จะได้ ส มการ
เป็น
MnO4- + 4H2O MnO2 + 2H2O + 4OH-
หักล้าง H2O
MnO4- + 2H2O MnO2 + 4OH-
ดุลประจุ
MnO4- + 2H2O +3 e- MnO2 + 4OH-
ทำา e- ทีถายเทให้เท่ากัน (โดยคูณไขว้จำานวน e- )
่ ่
Oxidation 2I- I2 + 2 e-
(1)
Reduction MnO 4- + 2H2O + 3 e-
MnO2 + 4OH -
(2)
(1)x3 จะได้ 6I-
3I2 + 6 e-
(2)x2 จะได้ 2MnO4- + 4H2O + 6 e-
2MnO2 + 8OH-
รวมสมการ 6I- + 2MnO4- + 4H2O 3I2 +
2MnO2 + 8OH -
- 11.
11
ประโยชน์ของเซลล์กัลวานิก
เซลล์กัลวานิก อาจแบ่งออกได้เป็น 2 ลักษณะ คือ
1. เซลล์ปฐมภูมิ< Primary Cell>
เป็นเซลล์ที่เมื่อใช้แล้วไม่อาจทำาให้กลับไปสู่สภาพเดิมได้อีกโดยใช้
ศักย์ไฟฟ้าภาพนอก เซลล์ชนิดนี้
ได้แก่ ดาเนียลเซลล์ เซลล์แห้ง และอื่นๆ
1.1 เซลล์แห้งหรือถ่านไฟฉาย
เซลล์แห้งหรือบางทีเรียกว่าเซลล์เลอคลัง เซลล์
(leclanche cell) เป็นเซลล์ทใช้ในไฟฉาย ซึ่งมีลักษณะตามรูปที่
ี่
1. กล่องของเซลล์ทำาด้วยโลหะสังกะสีซึ่งทำาหน้าที่เป็นขัวลบ ้
ส่วนแท่งคาร์บอนหรือแกไฟต์ทำาหน้าที่เป็นขัวบวก ภายในกล่อง
้
ระหว่างสองอิเล็กโตรดบรรจุด้วยของผสมของแอมโมเนียมคลอ
ไรด์, แมงกานีส (IV) ออกไซด์, ซิงค์ (II) คลอไรด์, ผงคาร์บอน
กับของแข็งอื่นทีไม่มีส่วนในการทำาปฏิกิริยาและทำาให้ชุ่มด้วยนำ้า
่
ระหว่างของผสมเหล่านี้กับกล่องสังกะสีกั้นด้วยกระดาษพรุน ตอน
บนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์
ให้คงที่ เมื่อเซลล์ทำาหน้าที่จายไฟฟ้า Zn จะละลายเป็น Zn2+เป็น
่
เหตุให้กล่องสังกะสีเป็นขั้วลบ ปฏิกิริยาที่เกิดขึ้นจึงเป็นปฏิกิริยา
ออกซิเดชัน
Zn(s) ------------> Zn2+(aq) + 2e-
ที่ขวบวก แมงกานีส(IV) ออกไซด์ก็จะถูกรีดิวซ์
ั้
ซึ่งมีปฏิกิริยาครึ่งเซลล์เป็นดังนี้
2MnO2(s) + 8NH4+(aq) + 2e---->2Mn3+(aq)-4H2O +
8NH3<(aq)
เพราะฉะนั้นปฏิกิริยาสุทธิทได้จากปฏิกิริยาครึ่งเซลล์ทงสอง จึง
ี่ ั้
เป็น
Zn(s) +2MnO2(s) + 8NH+4(aq)-------->Zn2+(aq) + 2Mn3+
(aq) + 8NH3(aq) +4H2O
ถ้ามีการจ่ายกระแสไฟฟ้ามากก็จะทำาให้เกิด NH3 ขึ้น ซึ่งจะ
เข้าทำาปฏิกิริยากับ Zn 2+
เกิดเป็นไอออนเชิงซ้อน เป็นต้นว่า
[Zn(NH3)4]2+ และ [ Zn(NH3)4 ]2+ และ [ Zn(NH3)2(H2O)2]2+
เซลล์แห้งดังกล่าวจะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ การเกิด
- 12.
12
ไอออนเชิงซ้อนช่วยรักษาความเข้มข้นของ Zn2+ ไม่ให้สูงขึ้นจึง
ทำาให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่เป็นเวลานานพอสมควร
รูปที่1. ส่วนประกอบของเซลล์
แห้ง
1.2 เซลล์สำาหรับวัตถุประสงค์พิเศษ
สำาหรับเซลล์วัตถุประสงค์พิเศษ ที่จะกล่าวถึง ได้แก่ เซลล์รู
บิน-มาลลอรี(Rubin-Mallory cell) หรือบางทีเรียกเซลล์
่
เมอร์คิวรี(Mercury cell) ซึ่งมีขนาดเล็กและใช้กันมากในเครื่องฟัง
เสียงสำาหรับคนหูพิการ หรือประโยชน์อื่นๆ เซลล์นี้ใช้กล่องสังกะสี
เป็นขั้วลบ แท่งคาร์บอน(แกรไฟต์ เป็นขัวบวก คล้ายกับของเซลล์
้
แห้ง แต่ใช้อิเล็กโตรไลต์เป็นของผสมที่ชุ่มและเหนียวของ
เมอร์คิวรี (II) ออกไซด์ โซเดียมหรือโพแทสเซียมไฮ ดรอกไซด์
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ และมีปฏิกิริยาเคมี
ดังนี้
- 13.
13
ขั้วลบ :Zn(s) + 2OH-(aq)-----------
>Zn(OH)2(s) + 2e-
ขั้วบวก :HgO(s) + 2H2O + 2e- --------->Hg(l)
+ 2OH-(aq)
ปฏิกิริยาสุทธิ : Zn(s) + HgO(s) + 2H2O ------
>Zn(OH)2(s) + Hg(l)
1.3 ดาเนียลเซลล์ (Daniel Cell)
จากภาพ อิเล็กโตรดทองแดงประกอบด้วยโลหะ
ทองแดงบรรจุอยูในสารละลายอิ่มตัวของคอปเปอร์(||) ซัลเฟต
่
(A) ส่วนล่างของเซลล์มีผลึกของคอปเปอร์ซัลเฟตเพื่อให้
สารละลายอิ่มตัว สารอิเล็กโตรดสังกะสีประกอบด้วย โลหะ
สังกะสี( B ) ลอยอยู่ในสารละลายสังกะสีซัลเฟตที่เจือจางไกล้ๆ
ส่วนบนของเซลล์ เหนือสารละลายคอปเปอร์ซัลเฟตซึ่งมีความ
หนาแน่นมากกว่า เมื่อโลหะสังกะสีและทองแดงเชื่อมต่อกันด้วย
ลวด อิเล็กตรอนจะไหลผ่านเส้นลวดจากสังกะสีซึ่งถูกออกซิไดซ์
ง่ายกว่าไปยังทองแดงซึ่งออกซิไดซ์ยากกว่า สังกะสีจะถูกออกซ
ไดซ์กลายเป็น Zn2+ ในสารละลาย ในขณะเดียวกัน Cu2+ จะถูก
รีดิวซ์เป็นทองแดง ดังสมการ แอโนด : Zn-------------
>Zn2+ + 2e-
แคโทด : Cu2+ + 2e-------------->Cu
ปฏิกิริยาสุทธิ Zn + Cu2+---------------->Zn2+ + Cu
ถ้าความเข้มข้นของ Zn2+ เพิ่มขึ้น ปฏิกิริยาที่ขั้วบวก ( anode )
จะเลื่อนไปทางซ้าย เป็นผลให้ศักย์ไฟฟ้าของเซลล์ลดลง
เซลล์ที่ใช้หลักการเดียวกับดาเนียลเซลล์ แต่ใช้แคดเมียมและนิ
เกิลแทนสังกะสีและทองแดงใช้กันมากในแบตเตอรี่ เพราะมีอายุ
การใช้งานทีนานกว่า
่
2. เซลล์ทุติยภูมิSecondary Galvanic Cell
เป็นเซลล์ที่สารซึงเป็นส่วนประกอบของเซลล์สามารถทำา
่
กลับให้อยูในสภาพเดิมได้อีกโดยให้กระแสไฟฟ้าไหลผ่านใน
่
ทิศทางตรงกันข้ามกับการจ่ายไฟ (Discharge) วิธีการนี้เป็นการ
ให้ประจุใหม่แก่เซลล์ เซลล์ชนิดนี้ได้แก่ แบตเตอรี่ตะกั่ว และ
แบตเตอรี่แบบเอดิสันเป็นต้น
2.1 แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว (lead storage battery)
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะ ประกอบด้วยอิเล็กโตรส
องอันซึ่งเป็นแผ่นตะกั่ว และแผ่นเลด(IV) ออกไซด์ มีกรดซัลฟุริก
- 14.
14
เจือจางเป็นอิเล็กโตรไลต์ เมื่อมีการจ่ายไฟฟ้า แผ่นตะกั่วจะถูก
ออกซิไดส์เป็นเลด(II) ไอออน และทำาหน้าที่เป็นขั้วลบ ดังรูป 2
Pb(s) --------->Pb2+(aq) + 2e-
เลด(II) ไอออนจะรวมตัวกับชัลเฟตไอออนเป็นเลด(II) ซัลเฟต
Pb2+(aq) + SO2-4(aq)------->PbSO4(s) รูปที2 ส่วน ่
ประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว
เมื่อรวมสมการทังสองเข้าด้วยกัน ก็จะเป็นปฏิกิริยาครึงเซลล์ที่มี
้ ่
การเกิดออกซิเดชัน
Pb(s) + SO2-4(aq) ------------>PbSO4(s) +2e-
อิเล็กตรอนจะเคลื่อนที่จากขั้วลบตามเส้นลวดไปยังอิเล็กโตรดอีก
อันหนึ่งที่เป็นเลด(IV) ออกไซด์ ซึ่งมีไฮโดรเจนไอออนจากอิเล็ก
โตรไลต์และจะถูกรีดิวซืดังสมการ
PbO2(s) +4H+(aq) +2e---------->Pb2+(aq) + 2H2O
และ Pb2+ จะรวมตัวกับ SO2-4 ทีมีในสารละลาย
่
Pb (aq) + SO 4(aq)------------>PbSO4 (s)
2+ 2-
ปฏิกิริยาที่เกิดขึ้นที่เลด (IV) ออกไซด์จึงเป็นปฏิกิริยาครึ่งเซลล์ที่
มีการเกิดรีดักชัน
PbO2(s) + 4H+(aq) + SO2-4(aq) + 2e- ------------
>PbSO4(s) + 2H2O
การจ่ายไฟฟ้าที่เกิดขึ้นจากทั้งสองอิเล็กโตรดอาจสรุปได้ดังนี้
ขั้วลบ : Pb(s) + SO2-4(aq)--------
>PbSO4(s) + 2e-
ขั้วบวก : PbO2(s) + 4H+(aq) + SO2-4(aq) +
2e------------>PbSO4(s) + 2H2O
ปฏิกิริยาสุทธิ : Pb(s) + PbO2(s) + 4H+(aq) +
2SO2-4(aq)----->2PbSO4(s) +2H2O
ปฏิกิริยาของเชลล์ข้างบนเป็นแบบผันกลับได้ เพราะฉะนั้น
ถ้าต้องการให้ผันกลับก็จำาเป็นจะต้องมีการอัดไฟฟ้า โดยการต่อขั้ว
บวกของเซลล์กับขั้วบวกของเครื่องอัดไฟฟ้าและขัวลบกับขัวลบ
้ ้
ของเครื่องอัดไฟฟ้า ปฏิกิริยาสุทธิข้างบนก็จะเปลี่ยนทิศทางเป็น
จากขวาไปซ้าย ในลักษณะนี้เลด(II) ซัลเฟตที่ขวลบก็จะเปลี่ยน
ั้
เป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด(II) ซัลเฟตจะเปลียนเป็นเลด (IV)
่
ออกไซด์ ตามปฏิกิริยาของแบตเตอรี่สะสมแบบตะกั่วจะเห็นว่า
ในขณะที่มีการจ่ายไฟฟ้า ความเข้มข้นของกรดจะลดลงเรื่อยๆ
ตามปกติตอนที่มีศักย์ ไฟฟ้าเต็มที่จะมีความถ่วงจำาเพาะ ประมาณ
- 15.
15
1.25 ถึง 1.30แล้วแต่อุณหภูมิในขณะนั้นๆ ถ้าหากเมื่อใดมี
ความถ่วงจำาเพาะตำ่ากว่า 1.20 ทีอุณหภูมิของห้องก็ควรจะมีการอัด
่
ไฟฟ้าได้ แต่ละเซลล์ของแบตเตอรี่จะมีศักย์ไฟฟ้าประมาณ 2
โวลต์ เพราะฉะนั้นถ้ารถยนต์ใช้แบตเตอรี่ 12 โวลต์ก็จะต้อง
ประกอบด้วย 6 เซลล์
2.ภาพประกอบของแบตเตอรี่สะสม
ไฟฟ้าแบบตะกั่ว
2.2 แบตเตอรี่สะสมไฟฟ้าแบบเอดิสัน (Edison storage battery)
แบตเตอรี่แบบนีประกอบแผ่นเหล็กกล้า บรรจุผงเหล็ก
้
ละเอียดส่วนนีทำาหน้าที่เป็นขั้วลบ สำาหรับขั้วบวกเป็นแผ่น
้
เหล็กกล้าบรรจุด้วยนิเกิล(IV) ออกไซด์ไฮเดรต ส่วนอิเล็ก
โตรไลต์เป็นสารละลายที่มีโพแทสเซียมไฮดรอกไซด์ 21% ผสม
ลิเทียมไฮดรอกไซด์เล็กน้อย เมื่อมีการจ่ายไฟฟ้า ปฏิกิรยาครึ่ง
่ ิ
เซลล์เกิดขึ้นดังนี้
ขั้วลบ : Fe(s) + 2OH-(aq) -----------
- 16.
16
>Fe(OH)2(s) + 2e-
ขั้วบวก : NiO2(s) + 2H2O + 2e- ----------
>Ni(OH)2(s) + 2OH-(aq)
ปฏิกิริยาสุทธิ : Fe(s) + NiO2(s) +
2H2O----------->Fe(OH)2(s) + Ni(OH)2(S)
เมื่อมีการอัดไฟฟ้า ปฏิกิริยาจะเปลี่ยนทิศทางจากขวา
ไปซ้าย ศักย์ไฟฟ้าของแต่ละเซลล์ของแบตเตอรี่แบบเอดิสัน มีค่า
ประมาณ 1.4 โวลต์
ถ้าใช้ผงแคดเมียมมาแทนผงเหล็กจะเป็นแบตเตอรี่
สะสมไฟฟ้าแบบนิกเกิล-แคดเมียม ซึ่งมีศักย์ไฟฟ้าประมาณ 1.3
โวลต์ และมีปฏิกิริยาครึ่งเซลล์ พอสรุปได้ดังนี้
ขั้วลบ : Cd(s) + 2OH-(aq) -----------
>Cd(OH)2(s) + 2e-
ขั้วบวก: NiO2(s) + 2H2O + 2e- -----------
>Ni(OH)2(s) + 2OH-(aq)
ปฏิกิริยาสุทธิ : Cd(s) + NiO2(s) + 2H2O ----------
>Cd(OH)2(s) + Ni(OH)2(s)
แบตเตอรี่ทั้งสองแบบที่กล่าวถึงในหัวข้อที่ 2. มีข้อดีคือ สามารถ
เก็บไว้นานๆได้โดยไม่เสื่อมคุณภาพ ให้ศักย์ไฟฟ้าค่อนข้างคงที่
ใช้กับอุปกรณ์วัดแสงในการถ่ายรูป เครื่องคิดเลข และอื่นๆ
ประโยชน์ของเซลล์อิเล็กโทรไลต์
การชุบ
หลักการทั่วไปสำาหรับการชุบโลหะด้วยไฟฟ้า
1.ใช้โลหะที่จะชุบเป็นแคโทด
2.จะชุบด้วยโลหะใดใช้โลหะนั้นเป็นแอโนด
3.สารละลายอิเล็กโทรไลต์ ต้องมีไอออนของโลหะที่เป็นแอโนด
4.ใช้ไฟฟ้ากระแสตรง และควบคุมศักดิ์ไฟฟ้าของเซลล์ให้เหมาะ
สม
เช่นการชุบช้อนสังกะสีด้วยเงิน กระทำาดังแผนภาพ
การทำาโลหะให้บริสุทธิ์
การทำาโลหะให้บริสุทธิ์ด้วยกระบวนการอิเล็กโทรลิซิส ใช้
หลักการเดียวกับกับการชุบด้วยไฟฟ้า โดยใช้โลหะที่บริสุทธิ์เป็น
แคโทด โลหะที่ไม่บริสุทธิ์เป็นแอโนด และใช้สารละลายที่มี
- 17.
17
ไอออนของโลหะดังกล่าวเป็นอิเล็กโทรไลต์ เช่นการทำาทองแดง
ให้บริสทธิ์
ุ
โดยทัวๆไปจะได้ทองแดงจากการถลุงแร่ ซึงจะมีความ
่ ่
บริสทธิ์ไม่เกิน 99% ทีเหลือจะเป็นพวกสิ่งเจือปนต่าง ๆ เช่น
ุ ่
Fe Ag Au Pt และ Zn ถ้าใช้กระบวนการอิเล็กโทรลิซิสเข้า
ช่วย จะได้ทองแดงที่มีความบริสุทธิ์ถึง 99.95% ใน
อุตสาหกรรมจะสร้างเซลล์ดังนี้
การผุกร่อนของโลหะและการ
ป้องกัน
การผุกร่อนของโลหะที่พบบ่อยในชีวิตประจำาวันได้แก่
เหล็กเป็นสนิม (สนิมเหล็กเป็นออกไซด์ของเหล็ก Fe2O3.xH2O)
ซึ่งเกิดจากสาเหตุหลายประการ ตัวอย่างเช่น การที่อะตอมของ
โลหะที่ถูกออกซิไดส์แล้วรวมตัวกับออกซิเจนในอากาศเกิดเป็น
ออกไซด์ของโลหะนั้น เช่น สนิมเหล็ก(Fe2O3) สนิมทองแดง
(CuO) หรือสนิมอลูมิเนียม(Al2O3) การเกิดสนิมมีกระบวนการซับ
ซ้อนมากและมีลักษณะเฉพาะตัวดังนี้
1. การผุกร่อนของโลหะ คือปฏิกิริยาเคมีที่เกิดระหว่างโลหะ
กับภาวะแวดล้อม
2. ภาวะแวดล้อมที่ทำาให้ผุกร่อน คือ ความชื้น และ
ออกซิเจน(H2O, O2) หรือ H2O กับอากาศ
3. ปฏิกิริยาเคมีที่เกิดในการผุกร่อน เป็นปฏิกิริยารีดอกซ์
3.1 โลหะที่เกิดปฏิกิริยา Oxidation (ให้อิเล็กตรอน)
3.2 ภาวะแวดล้อมเป็นฝ่ายรับอิเล็กตรอน เกิดปฏิกิริยา Reduction
4. สมการแสดงปฏิกิริยาการผุกร่อน (เกิดจากการทดลอง)
โลหะ + ภาวะแวดล้อม -----> Ion ของโลหะ + เบส
Fe (s) + H2O (l) + O2 (g) -----> Fe2+ (aq) + OH-
(aq)
Fe2+ ทดสอบโดยใช้สารละลาย K3Fe(CN)6 จะได้สีนำ้าเงิน ถ้า
สีนำ้าเงินเข้ม แสดงว่ามี Fe2+ มาก ถ้าจางมี Fe2+ น้อย
เบส(OH-) ทดสอบโดยสารละลายฟินอล์ฟทาลีน ได้สีชมพู
5. ในการ Balance สมการ
เมื่อเหล็กสัมผัสกับอากาศและความชื้น อะตอมของเหล็กจะเกิด
ปฏิกิริยาออกซิเดชันดังสมการ
- 18.
18
Fe (s) ------> Fe2+ (aq) + 2e …………………………….
….(1) (Oxidation)
นำ้าและออกซิเจนรับอิเล็กตรอนจากเหล็ก ดังสมการ
2H2O (l) + O2 (g) + 4e ------> 4OH- (aq)
…………………..(2) (Reduction)
(1) * 2 + (2) ; 2Fe + 2H2O + O2 -------> 2Fe2+ + 4OH-
(Redox)
การป้องกันสนิมเหล็ก
1. ทาสี ทานำ้ามัน การรมดำา และการเคลือบพลาสติก
เป็นการป้องกันการถูกกับ O2 และความชื้น ซึ่งเป็นการป้องกันการ
เกิดสนิมของโลหะได้และเป็นวิธีที่สะดวกและให้ผลดีในการ
ป้องกันสนิม
2. โลหะบางชนิดมีสมบัติพิเศษ กล่าวคือเมื่อทำาปฏิกิริยา
กับออกซิเจนจะเกิดเป็นออกไซด์ของโลหะเคลือบอยู่บนผิวของ
โลหะนั้นและไม่เกิดการผุกร่อนอีกต่อไป โลหะที่มีสมบัติดังกล่าว
ได้แก่ อลูมิเนียม ดีบุก และสังกะสี การชุบ หรือเคลือบโดยโลหะที่
Oxide ของโลหะนั้นคงตัว สลายตัวยาก จะเป็นผิวบางๆ คลุมผิว
โลหะอีกที ได้แก่ Cr (โครเมียม) และอลูมิเนียม(Al) เป็นต้น ดัง
นั้น Cr2O3.Al2O3 สลายตัวยาก เรียกชื่อว่าวิธี อะโนไดซ์ (Anodize)
หมายเหตุ เหล็กกล้าไม่เกิดสนิม (stainless steel) เป็น Fe
ผสม Cr
3. การผุกร่อนของโลหะมีปฏิกิริยาเกิดขึ้นเช่นเดียวกับ
แอโนดในเซลล์อิเล็กโทรไลต์ ดังนั้นถ้าไม่ต้องการให้เกิดการผุ
กร่อนจึงต้องให้โลหะนันมีสภาวะเป็นแคโทดหรือคล้ายกับแคโทด
้
โดยใช้โลหะที่เสีย e- ง่ายกว่าเหล็กไปอยู่กับเหล็ก ได้แก่ Fe ชุบ
Zn สำาหรับมุงหลังคา การฝังถุง Mg ตามท่อ หรือการผูก Mg ตาม
โครงเรือ จะทำาให้ Fe ผุช้าลง เนื่องจาก Zn & Mg เสีย e ง่ายกว่า
Fe จะเสีย e แทน Fe เรียกชื่อวิธี แคโธดิก (Cathodic)
4. การป้องกันการผุกร่อนของโลหะในระบบหล่อเย็นแบบปิด
เครื่องยนต์ที่ใช้ในรถยนต์หรือเครื่องมือผลิตกระแสไฟฟ้าจะ
ใช้ระบบหล่อเย็นแบบปิดเพื่อรักษาอุณหภูมิของเครื่องยนต์ไม่ให้
สูงมากเกินไป สารหล่อเย็นทีใช้คือนำ้าซึ่งมีออกซิเจนละลายอยู่ ถ้า
่
เครื่องยนต์มีโลหะผสมของอลูมิเนียม ออกซิเจนที่ละลายอยูในนำ้า่
จะถูกใช้ในการสร้างฟิลมอลูมิเนียมออกไซด์ และฟิล์มนี้จะป้องกัน
์
การผุกร่อนเครื่องยนต์ได้ แต่ถ้าเครื่องยนต์มีส่วนประกอบที่เป็น
- 19.
19
โลหะผสมของเหล็ก ส่วนประกอบของเครื่องยนต์ที่สัมผัสกับนำ้าจะ
เกิดการผุกร่อนได้ เนื่องจากออกไซด์ของเหล็กไม่มีสมบัติในการ
เป็นสารเคลือบผิวจึงต้องเติมสารยับยังการกัดกร่อนซึ่งประกอบ
้
ด้วยสารประกอบของไนไตรต์โบแรกซ์ สารนี้จะทำาให้นำ้าในระบบ
หล่อเย็นมี pH สูงกว่า 8.5 และทำาให้โลหที่เป็นส่วนประกอบของ
เครื่องยนต์เกิดปฏิกิริยาออกซิเดชันได้ยาก การผุกร่อนของโลหะ
จึงลดลง นอกจากนี้การใช้ระบบปิดมีผลดีอีกประการหนึ่งคือ
เป็นการจำากัดปริมาณของออกซอเจนที่ละลายลงไปในนำ้าจึงทำาให้
การผุกร่อนของโลหะลดลง
ความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้องกับเซลล์ไฟฟ้า
เคมี
1. การทำาอิเล็กโทรไดอะลิซิสนำ้าทะเล
อิเล็กโทรไดอะลิซิสเป็นเซลล์อิเล็กโทรไลต์ที่ใช้แยกไอออน
ออกจากสารละลายโดยให้ไอออนเคลื่อนที่ผ่านเยื่อบางๆ ไปยัง
ขั้วไฟฟ้าที่มีประจุตรงกันข้ามซึ่งอยูริมทังสองด้านทำาให้สารละลาย
่ ้
ส่วนกลางมีความเข้มข้นไอออนลดลงจึงนำาหลักการนี้ไปแยก
ไอออนของโซเดียมและคลอไรด์ไอออนออกจากนำ้าทะเลเพื่อ
ผลิตนำ้าจืดจากทะเลได้
2. เซลล์เชื้อเพลิง (fuel cell)
อีกวิธีหนึ่งที่ใช้เปลียนพลังงานเคมีเป็นพลังงานไฟฟ้าได้แก่
่
เซลล์เชื้อเพลิง ซึ่งมีได้หลายแบบ ขึ้นกับว่าจะใช้สารอะไรเป็นเชื้อ
เพลิง เช่น ออกซิเจน(จากอากาศ) และนำ้ามันเชื้อเพลิง (fossil
fuel) หรือไฮโดรเจนและไฮดราซีน (hydrazine,N2H4) แต่เชื้อ
เพลิงทีใช้กันมากได้แก่ H2 และ O2 ซึ่งใช้กันในยานอวกาศ เพราะ
่
เชื้อเพลิงที่ใช้ยิงจรวดเป็นเชื้อเพลิงชนิดเดียวกัน เซลล์เชื้อ
เพลิง H2 - O2 แสดงในรูป ซึ่งแบ่งได้เป็นสามห้อง คือห้องทาง
ซ้ายเป็นทางเข้าของ H2 และห้องทางขวาซึ่งเป็นทางเข้าของ O2
และห้องที่มีตำาแหน่งอยู่กลางบรรจุอิเล็กโตรไลต์ซึ่งเป็น
สารละลายเบส ห้องทั้งสามแยกออกจากกันด้วยขั้วไฟฟ้าที่มี
ลักษณะพรุน (porous electrode) ทีทำาด้วยวัตถุตัวนำา เช่น
่
คาร์บอนผสมด้วยแพลตินัมเล็กน้อย เพื่อทำาหน้าที่เป็นตัวเร่ง เมื่อ
ป้อน H2 และ O2 เข้าทางห้องทางซ้ายและทางขวาพร้อมกัน แก๊ส
ทั้งสองจะแพร่ผ่านไปยังขัวไฟฟ้า และทำาปฏิกิริยากับอิเล็ก
้
- 20.
20
โตรไลต์ในห้องกลาง ออกซิเจนถูกรีดิวซ์ที่คาโทดเกิดเป็น OH-
ดังนี้
คาโทดO2(g)+2H2O(I)+4e- ------------------>4OH-(aq)
อิออน OH-จะซึมผ่านไปยังแอโนด และทำาปฏิกิริยากับ H2 ดังนี้
H2(g)+2OH-(aq)------------------>2H2O(I)+2e-
ปฏิกิริยาสุทธิของเซลล์คือ การเปลี่ยน H2 (g)และ O2(g) เป็นนำ้า
นั่นเอง
2H2(g)+O2(g) ------------------> 2H2O(I)
โดยปกติจะใช้อุณหภูมิสูงพอ เพื่อนำ้าทีได้สามารถระเหยออกจาก
่
เซลล์ และควบแน่นเป็นนำ้าดื่มสำาหรับมนุษย์อวกาศ ถ้านำาเชื้อเพ
ลิงหลายๆเซลล์มาต่อเข้าด้วยกัน จะสามารถผลิตกระแสไฟฟ้าได้
หลายๆกิโลวัตต์ เซลล์เชื้อเพลิงมีข้อดีหลายประการเมื่อเปรียบ
เทียบกับเซลล์แห้งหรือเซลล์สะสมตะกั่ว เช่นสามารถป้อนเชื้อ
เพลิงตลอดเวลา จึงได้เกิดพลังงานขึ้นอย่างไม่มีที่สิ้นสุดและมี
ประสิทธิภาพสูงกว่า นอกจากนี้แล้ว เซลล์เชื้อเพลิงสามารถ
เปลียนพลังงานเคมีเป็นพลังงานไฟฟ้าได้โดยตรง โดยไม่มี
่
ผลิตผลพลอยได้ทไม่พึงปรารถนาอย่างอื่น (การผลิตกระแส
ี่
ไฟฟ้าทีใช้กันในปัจจุบันทั่วไปต้องใช้เชื้อเพลิงในการต้มนำ้าให้ได้
่
ไอเพื่อนำาไปหมุนกังหันที่ต่อ) และยังมีประสิทธิภาพสูงกว่า (
เซลล์เชื้อเพลิงอาจมีประสิทธิภาพมากกว่า 80% เปรียบเทียบกับ
เครื่องกำาเนิดไฟฟ้ากังหันไอนำ้า ซึ่งทัวไปสูงเพียงประมาณ 40%
่
เท่านั้น)เซลล์เชื้อเพลิงจึงอาจเป็นแหล่งพลังงานทีสำาคัญใน
่
อนาคต
- 21.









![11
ประโยชน์ของเซลล์กัลวานิก
เซลล์กัลวานิก อาจแบ่งออกได้เป็น 2 ลักษณะ คือ
1. เซลล์ปฐมภูมิ< Primary Cell>
เป็นเซลล์ที่เมื่อใช้แล้วไม่อาจทำาให้กลับไปสู่สภาพเดิมได้อีกโดยใช้
ศักย์ไฟฟ้าภาพนอก เซลล์ชนิดนี้
ได้แก่ ดาเนียลเซลล์ เซลล์แห้ง และอื่นๆ
1.1 เซลล์แห้งหรือถ่านไฟฉาย
เซลล์แห้งหรือบางทีเรียกว่าเซลล์เลอคลัง เซลล์
(leclanche cell) เป็นเซลล์ทใช้ในไฟฉาย ซึ่งมีลักษณะตามรูปที่
ี่
1. กล่องของเซลล์ทำาด้วยโลหะสังกะสีซึ่งทำาหน้าที่เป็นขัวลบ ้
ส่วนแท่งคาร์บอนหรือแกไฟต์ทำาหน้าที่เป็นขัวบวก ภายในกล่อง
้
ระหว่างสองอิเล็กโตรดบรรจุด้วยของผสมของแอมโมเนียมคลอ
ไรด์, แมงกานีส (IV) ออกไซด์, ซิงค์ (II) คลอไรด์, ผงคาร์บอน
กับของแข็งอื่นทีไม่มีส่วนในการทำาปฏิกิริยาและทำาให้ชุ่มด้วยนำ้า
่
ระหว่างของผสมเหล่านี้กับกล่องสังกะสีกั้นด้วยกระดาษพรุน ตอน
บนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์
ให้คงที่ เมื่อเซลล์ทำาหน้าที่จายไฟฟ้า Zn จะละลายเป็น Zn2+เป็น
่
เหตุให้กล่องสังกะสีเป็นขั้วลบ ปฏิกิริยาที่เกิดขึ้นจึงเป็นปฏิกิริยา
ออกซิเดชัน
Zn(s) ------------> Zn2+(aq) + 2e-
ที่ขวบวก แมงกานีส(IV) ออกไซด์ก็จะถูกรีดิวซ์
ั้
ซึ่งมีปฏิกิริยาครึ่งเซลล์เป็นดังนี้
2MnO2(s) + 8NH4+(aq) + 2e---->2Mn3+(aq)-4H2O +
8NH3<(aq)
เพราะฉะนั้นปฏิกิริยาสุทธิทได้จากปฏิกิริยาครึ่งเซลล์ทงสอง จึง
ี่ ั้
เป็น
Zn(s) +2MnO2(s) + 8NH+4(aq)-------->Zn2+(aq) + 2Mn3+
(aq) + 8NH3(aq) +4H2O
ถ้ามีการจ่ายกระแสไฟฟ้ามากก็จะทำาให้เกิด NH3 ขึ้น ซึ่งจะ
เข้าทำาปฏิกิริยากับ Zn 2+
เกิดเป็นไอออนเชิงซ้อน เป็นต้นว่า
[Zn(NH3)4]2+ และ [ Zn(NH3)4 ]2+ และ [ Zn(NH3)2(H2O)2]2+
เซลล์แห้งดังกล่าวจะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ การเกิด](https://image.slidesharecdn.com/random-120516030858-phpapp02/85/slide-11-320.jpg)









