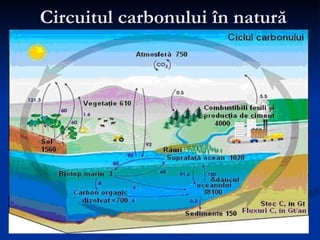
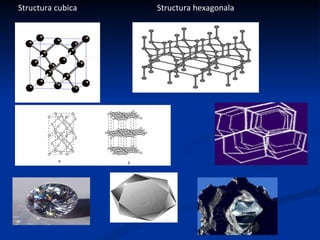
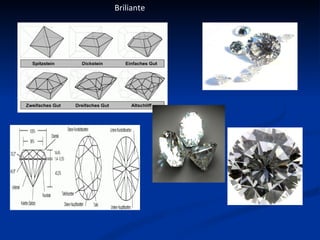
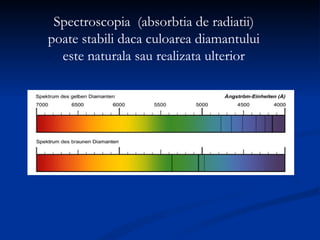
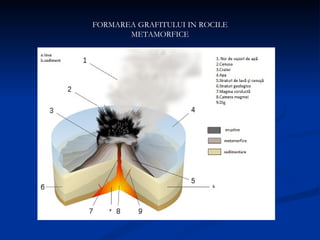
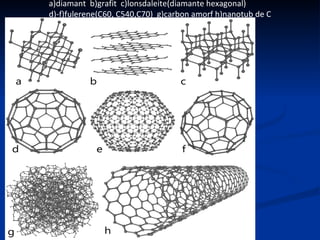
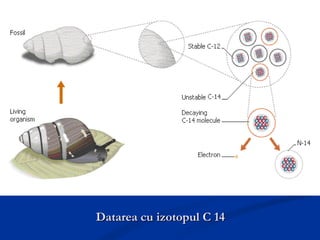
Carbonul este un element versatil, cunoscut că are forme alotropice precum diamantul, grafitul, și grafenul, având capacitatea de a forma legături chimice complexe. Diamentul se formează la adâncimi mari și temperaturi ridicate, poseda duritate maximă, și este utilizat în bijuterii și instrumente de tăiere, în timp ce grafitul, cu o structură stratificată, este folosit în creioane și reactoare nucleare. Grafenul, o variantă bidimensională a grafitului, este cel mai bun conductor de electricitate și căldură, având aplicații promițătoare în diverse tehnologii.