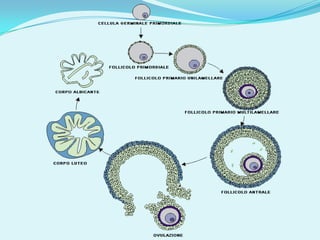
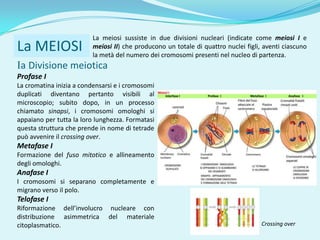
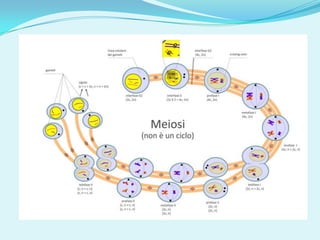
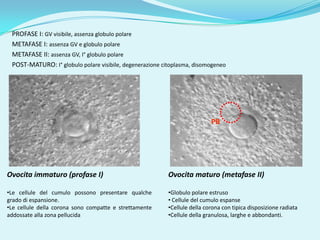
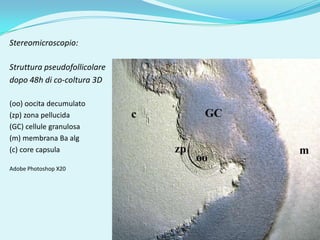
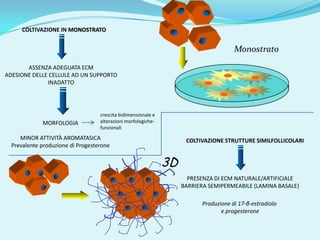
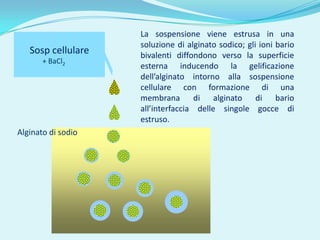
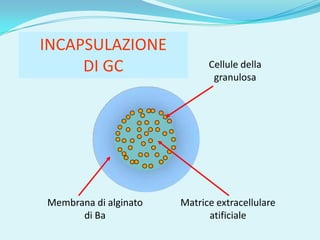
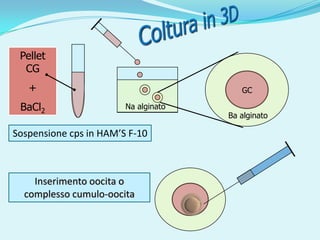
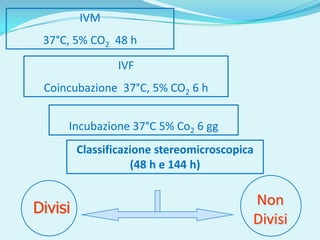
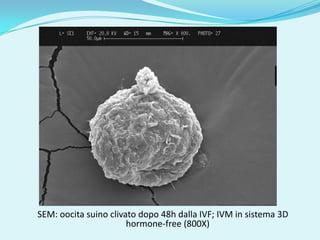
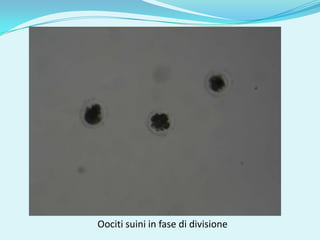
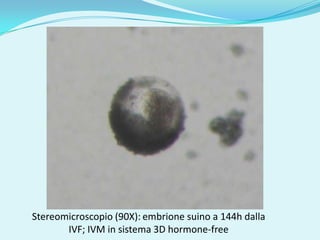
Il documento discute l'importanza della maturazione degli oociti e delle tecniche in vitro come l'IVM e l'IVF per migliorare la fertilizzazione negli ambiti veterinario e umano. Viene evidenziato il ruolo cruciale delle cellule della granulosa nella maturazione degli oociti e nello sviluppo embrionale. Inoltre, la co-coltura 3D dimostra un'efficacia superiore rispetto ai metodi tradizionali nel promuovere la competenza di maturazione degli oociti.