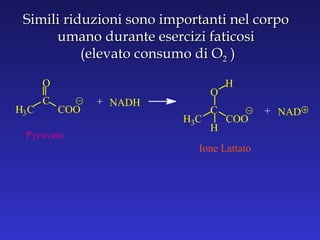
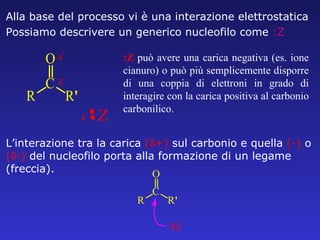
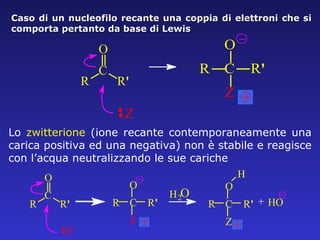
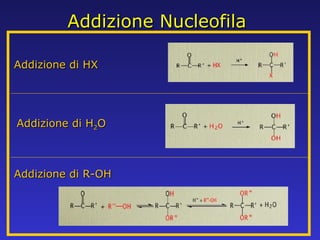
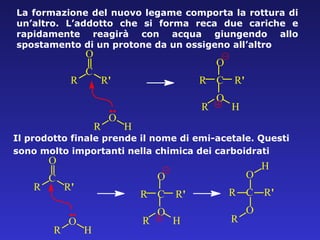
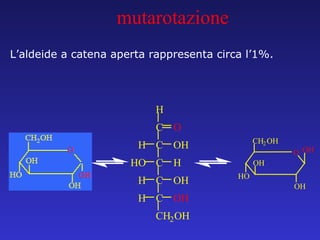
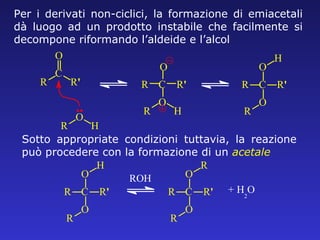
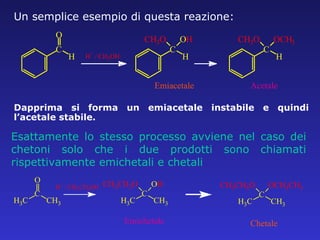
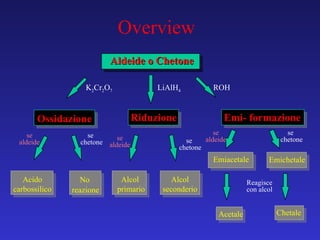
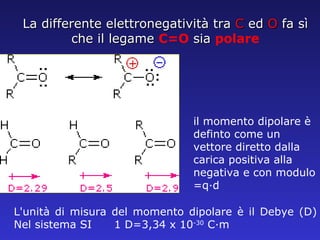
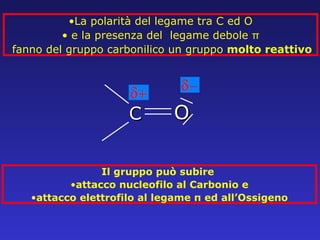
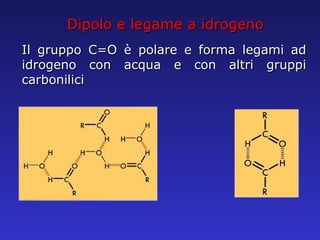
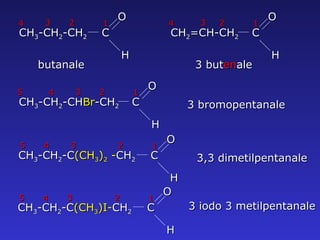
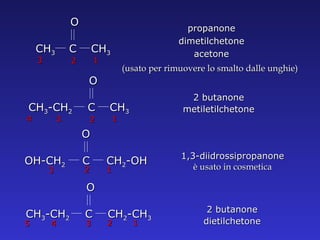
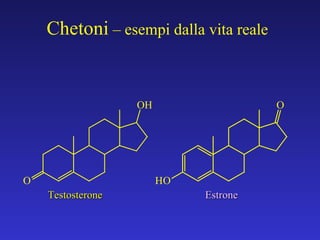
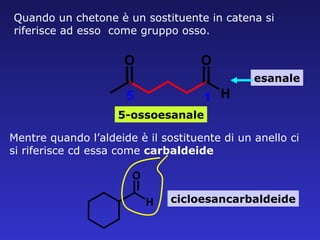
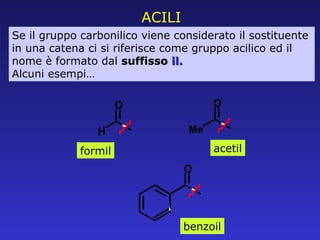
Il documento analizza la struttura e le proprietà delle aldeidi e dei chetoni, evidenziando la presenza del gruppo carbonilico e la sua reattività. La nomenclatura IUPAC per aldeidi e chetoni è descritta, insieme alle loro proprietà fisiche e alle reazioni di ossidazione e riduzione. Inoltre, viene spiegato il meccanismo delle reazioni di addizione nucleofila che coinvolgono queste classi di composti.












![Preparazione aldeidi e chetoni Ossidazione degli alcoli R-OH [O] ALDEIDE O CHETONE Il tipo di alcool determina il prodotto](https://image.slidesharecdn.com/5c2009aldeidiechetoni-091219031455-phpapp02/85/5-C-2009-Aldeidi-E-Chetoni-22-320.jpg)
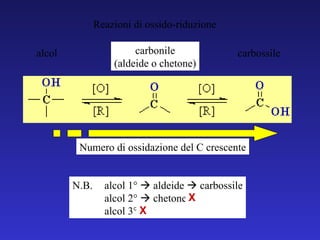

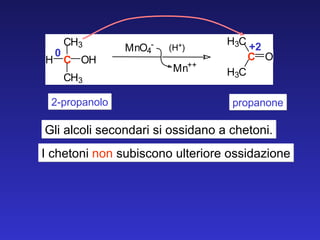
![primario aldeide secondario chetone terziario Nessuna reazione ossidazione degli alcoli [O] [O] [O]](https://image.slidesharecdn.com/5c2009aldeidiechetoni-091219031455-phpapp02/85/5-C-2009-Aldeidi-E-Chetoni-27-320.jpg)
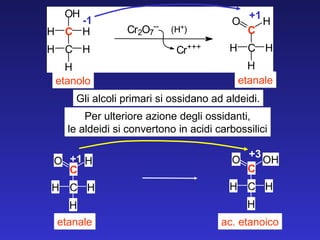
![Alcol secondario Aldeide Alcol primario chetone Le aldeidi a differenza dei chetoni subiscono facilmente un’altra reazione di ossidazione almeno fino all’acido corrispondente o in extremis a CO 2 Esempi di ossidazione degli alcoli CH 2 OH [ O ] C H O C CH 3 O CH CH 3 OH [ O ]](https://image.slidesharecdn.com/5c2009aldeidiechetoni-091219031455-phpapp02/85/5-C-2009-Aldeidi-E-Chetoni-28-320.jpg)

![Riduzione Aldeidi vengono ridotte ad alcoli primari In un processo opposto alla ossidazione, aldeidi e chetoni si riducono ai rispettivi alcoli La reazione può avvenire con idrogenazione catalitica o mediante attacco nucleofilo da parte di idruri metallici (es. NaBH 4 ed il più efficace LiAlH 4 ) Reazioni delle aldeidi & chetoni Chetoni vengono ridotti ad alcoli secondari La riduzione aggiunge essenzialmente una molecola di idrogeno al doppio legame C=O [H 2 ] [H 2 ]](https://image.slidesharecdn.com/5c2009aldeidiechetoni-091219031455-phpapp02/85/5-C-2009-Aldeidi-E-Chetoni-30-320.jpg)