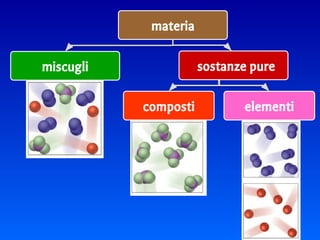
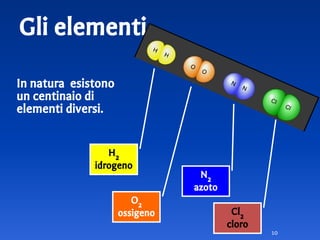
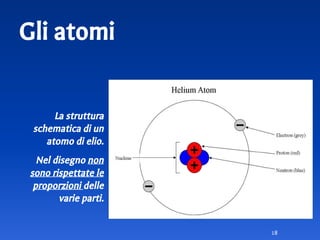
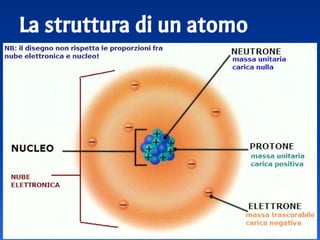
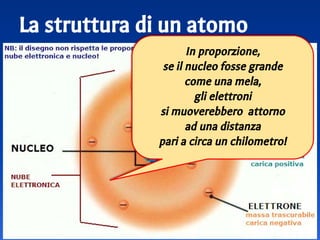
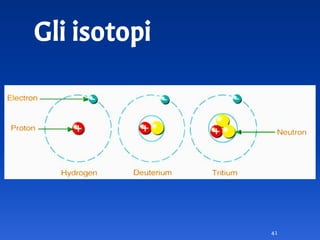
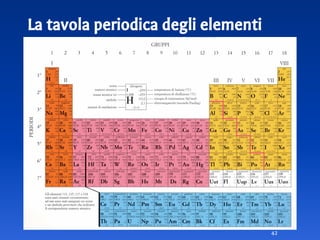
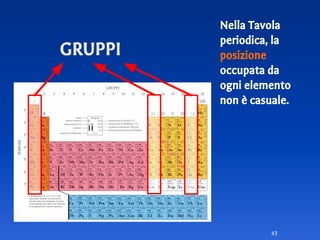
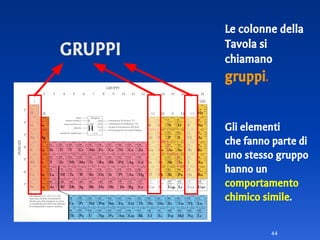
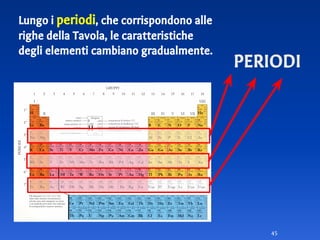
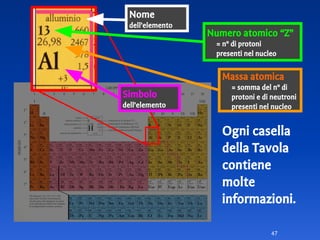
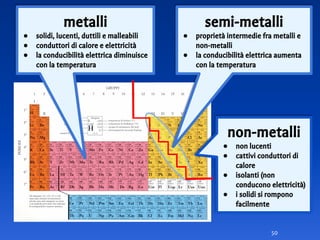
Il documento spiega le differenze tra elementi, composti e sostanze pure, chiarendo che le sostanze pure non possono essere separate fisicamente e che i composti sono formati da molecole di atomi combinati. Viene introdotto il concetto di atomo e il numero atomico, evidenziando che ogni elemento ha un numero di protoni specifico che ne determina le proprietà. Inoltre, si discute la tavola periodica degli elementi, la massa atomica e le formule chimiche, fornendo esempi pratici per il calcolo delle masse molecolari.