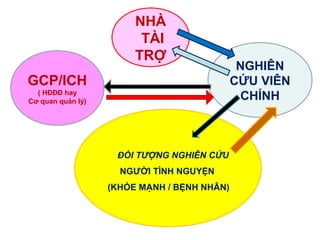
Tài liệu đánh giá các vấn đề đạo đức liên quan đến nghiên cứu y sinh học, bao gồm trách nhiệm và nghĩa vụ của nghiên cứu viên chính, nghiên cứu viên, và các đối tượng tham gia. Nó liệt kê các yêu cầu về chuyên môn, quy trình nghiên cứu, và quản lý dữ liệu nhằm đảm bảo an toàn cho người tham gia. Các điều kiện và quy chế chi tiết cũng được nêu rõ để việc thực hiện nghiên cứu diễn ra đúng quy định và có tính pháp lý.