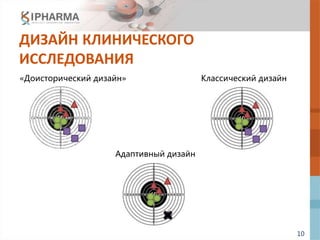
Документ обсуждает эффективный дизайн клинических исследований, акцентируя внимание на адаптивном дизайне в фазах 2 и 3, его преимуществах, рисках и примерах реализации. Также рассматриваются препараты next-in-class и различные методологии, которые могут повысить эффективность исследований и снизить затраты. В заключение подчеркивается, что адаптивный дизайн оптимизирует разработку инновационных препаратов.






![9
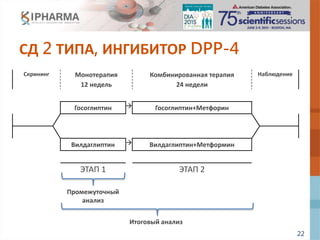
ПРИНЦИПЫ РАЗРАБОТКИ ДИЗАЙНА
ИССЛЕДОВАНИЯ
• Основная конечная точка
• Частота достижения эффекта
• Изменение показателя
• Гипотеза
• Превосходство
• Не уступающая [эффективность]
• Эквивалентность
Цель
исследования
Механизм
действия
препарата
Основная
конечная точка
Гипотеза
Н0 ↔ На
Расчет размера
выборки
Длительность
терапии и
наблюдения
Способ сбора
данных
Алгоритм
принятия
решения
Ожидаемое
значение в группе
контроля](https://image.slidesharecdn.com/2015-160829143903/85/slide-9-320.jpg)










![24
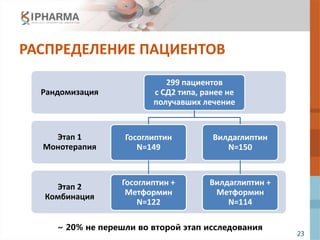
ПРОМЕЖУТОЧНЫЙ И ИТОГОВЫЙ
АНАЛИЗ
∆HbA1c, % Госоглиптин Вилдаглиптин
Монотерапия (Н12-Н0) -0.93% -1.03%
∆
[97.5% CI]
0,104%
[-0,133 до 0,342]
верхняя граница
97.5% ДИ < 0.4
Комбинация (Н36-Н0) -1.29% -1.35%
∆
[97.5% CI]
0,057%
[-0,187 до 0,300]
верхняя граница
97.5% ДИ < 0.4](https://image.slidesharecdn.com/2015-160829143903/85/slide-24-320.jpg)


![29
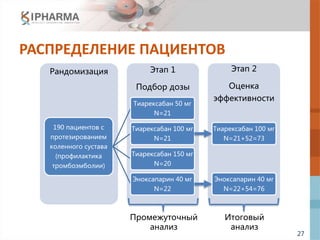
ИТОГОВЫЙ АНАЛИЗ
(150 ПАЦИЕНТОВ, ВТЭ, NON-INFERIORITY)
Тиарексабан 100 мг
N = 73
Эноксапарин
N = 76
Суммарный показатель ВТЭ 14 (19.2%) 21 (27.6%)
∆
[97.5% CI]
8.45%
[-3.01%; 19.59%]
Нижняя граница
97.5% ДИ > -5.00%
частота развития ТГВ 14 (19.2%) 20 (26.3%)
частота развития симптоматической ВТЭ
(ТГВ, ТЭЛА)
0 (0.0%) 2 (2.6%)
частота развития несмертельной ТЭЛА 0 (0.0%) 1 (1.3%)
Общая частота геморрагических осложнений 1 (1.4%) 2 (2.6%)
частота больших и клинически значимых
малых кровотечений
0 (0.0%) 2 (2.6%)](https://image.slidesharecdn.com/2015-160829143903/85/slide-29-320.jpg)


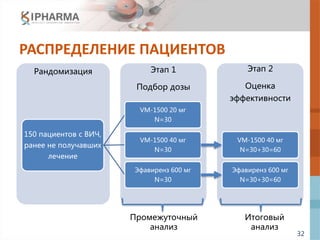
![33
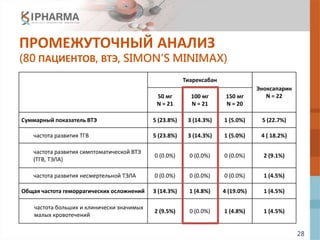
ПРОМЕЖУТОЧНЫЙ АНАЛИЗ
(90 ПАЦИЕНТОВ, РНК ВИЧ < 400 КОПИЙ/МЛ НА
НЕДЕЛЕ 12, NON-INFERIORITY)
Пациенты с РНК ВИЧ < 400 копий/мл
Неделя
VM-1500 20 мг
N=30
VM-1500 40 мг
N=29
EFV 600 мг
N=27
Н12 28 (93.3%) 25 (86.2%) 22 (81.5%)
∆
[97.5% CI]
11.85%
[-2.59%; 26.92%]
4.73%
[-11.50%; 20.83%]
Нижняя граница
97.5% ДИ > -15.00%
* Итоговый анализ в Q1 2016 г.](https://image.slidesharecdn.com/2015-160829143903/85/slide-33-320.jpg)

