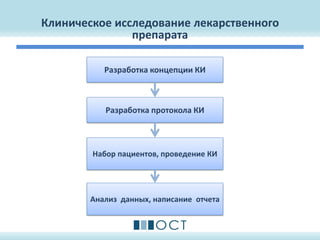
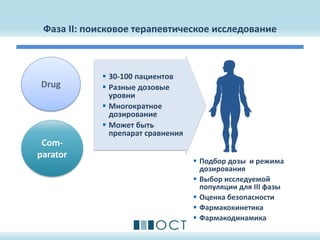
Документ описывает методологию и дизайн клинических исследований лекарственных препаратов, включая фазы I, II и III, и соответствующие требования и руководства, такие как ICH GCP и федеральные законы России. Он охватывает ключевые аспекты разработки протокола клинического исследования, включая выбор пациентов, сбор данных и анализ, а также цели исследований и параметры оценивания эффективности и безопасности. Также рассматриваются примеры и общие требования к дизайну клинических исследований, чтобы обеспечить соответствие международным стандартам.