Dokumen ini merupakan review mengenai beberapa metode sintesis nanomaterial seperti nanopartikel, nanotube, dan komposit nanopartikel. Metode-metode yang diulas antara lain pemanasan sederhana dalam larutan polimer untuk membuat berbagai jenis oksida logam, sintesis koloid untuk memproduksi material semikonduktor dan logam mulia, serta reaksi kimia basa untuk menghasilkan senyawa seperti sulfida kadmium.







![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 40
Setelah itu, dilakukan analisis sinar-X dan didapat logam
Ni, besi oksida dan Ni-besi dalam bentuk kristal.
Silika basah disiapkan melalui proses hidrolisis
dan kondensasi tetraethoxysilane (TEOS) dengan 2 jenis
asam-basa sebagai katalisator proses sol-gel (katalisnya
adalah hidroklorik dan ammonia). Pada tahap pertama,
pra-polimerisasi dari TEOS didapat melalui reaksi dari
TEOS dengan air dan asam katalis (HCl 1 M) pada
larutan etanol.
Setelah dibiarkan pada suhu 25 o
C selama 1 bulan,
didapat cairan yang viskositasnya tinggi. Pada tahap
kedua, 0,05 M larutan NH3 ditambahkan kepada sol asam.
Setelah 48 jam, gel dari sampel matriks diperoleh. Lalu,
cairan yang mengandung pori-pori dari gel silica diganti
dengan etanol. Dua sampel didapat dengan cara
menyebarkan gel silica melalui larutan alcohol yang
supersaturasi (anhydrous Ni(II) acetylacetonate atau
anhydrous Fe(II) acetylacetonate). Pengeringan dilakukan
pada proses penyebaran ini. Proses pengeringan ini terjadi
pada suhu 260 o
C dan tekanan 131 bar. Setelah 3 jam,
tekanan dikurangi secara perlahan. Aerogel yang didapat
dibiarkan mendingin secara perlahan sampai suhunya
sama dengan suhu kamar.
Gambar 13 (a) Hasil dari difraksi sinar-X dan (b) ZFC
magnetisasi dari nanopartikel cobalt.
Nanopartikel cobalt
Nanopartikel cobalt disintesis dengan cara
dekomposisi yang cepat dari material prekursor
(organometallic) pada larutan yang mengandung
surfaktan pada lingkungan berisi argon. Cobalt carbonyl
[1,58 mmol (0,54 g)] dilarutkan di dalam 3 ml 1,2-
dichlorobenzene (DCB) yang mengandung 0,6 mmol(0,2
ml) asam oleic dan 1,1 mmol (0,34 ml) dioctylamine serta
diaduk selama 15 menit. Struktur kristal dari bahan ini
lalu dikarakterisasi dengan difraksi sinar-X dan TEM.
Sifat magnetik dari bahan ini lalu dipelajari dengan
SQUID (Superconducting Quantum Interface Device).
Pada karakterisasi ini, yang diukur dari bahan tersebut
adalah ZFC (Zero Field Cooled) magnetisasi bahan.
Gambar 13 adalah pola difraksi sinar-X dan ZFC dari
nanopartikel cobalt.
Nanopartikel Co-Au Core-Shell (teras-kulit)
Gambar 14 (a) Hasil dari difraksi sinar-X dan (b) ZFC
magnetisasi dari nanopartikel Co-Au. Inset merupakan 5
K histerisis yang menunjukkan sifat feromagnetik dari
bahan tersebut pada suhu rendah.
Nanopartikel yang belum jadi dapat dijadikan
sebagai inti dari nanopartikel yang akan dibuat. Cobalt
dijadikan sebagai inti sedangkan Au sebagai kulit dari
nanopartikel tersebut. Larutan prekursor teras cobalt [0,5
ml (3 mmol/ml)] dicampur dengan 5 ml toluene dan
diberi semburan gas argon selama 30 menit. Kemudian
larutan 0,01 g HAuCl4, 0,25 ml oleylamine dan 3 ml
toluene dimasukkan ke larutan tersebut pada suhu 85 o
C.
Setelah terjadi reaksi, larutan dijaga pada suhu tersebut
selama 1 jam. Nanopartikel core-shell terbentuk dengan
Suhu (K)
1 10 100 1000
Momen(sembarang)Intensitas(sembarang)
2θ
35 45 555040
221
310
311
Suhu (K)
1 10 100 1000
Momen(sembarang)Intensitas(sembarang)
2θ
35 45 555040
221
310
311
10000-10000 0
Medan (Oe)
M(emu/g)
T = 5 K
2θ
40 50 807060
ε-Co
fcc-Au
0,02
0,2
2
FC
ZFC
0 50 100 150 200 250 300 350
Suhu (K)
H = 20 G
Magnetization(emu/g)Intensitas
Intensitas
40 50
(a)
(b)
10000-10000 0
Medan (Oe)
M(emu/g)
T = 5 K
2θ
40 50 807060
ε-Co
fcc-Au
0,02
0,2
2
FC
ZFC
0 50 100 150 200 250 300 350
Suhu (K)
H = 20 G
Magnetization(emu/g)Intensitas
Intensitas
40 50
(a)
(b)](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-9-320.jpg)
![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 41
ukuran inti 6 nm dan ukuran kulit 1,5 nm. Karakterisasi
dari nanopartikel ini dilakukan dengan cara yang sama
dengan nanopartikel sebelumnya. Gambar 14 adalah pola
difraksi sinar-X dan ZFC dari nanopartikel Co-Au
Reverse Micelle
Cara lain membuat partikel koloid dengan ukuran
nanometer adalah metode reverse micelles. Micelle
adalah partikel koloid berongga yang umumnya berupa
material organik yang terbentuk secara spontan (self
asembli) seperti diilustrasikan pada Gbr 15. Dengan cara
sonifikasi (getaran dengan gelombang bunyi), kation (ion
positif) dipaksa masuk ke dalam rongga micelle (lihat Gbr
16).
Gambar 15 Contoh micelle.
Gambar 16 Sonifikasi memaksa masuk kation ke dalam
rongga micelle.
Kemudian anion (ion negatif) dibuat dalam larutan
yang mengandung micelle. Anion dibiarkan berdifusi ke
dalam rongga micelle yang telah mengandung ion positif
melaui selaput micelle (lihat ilustrasi pada Gbr 3.20).
Rongga micelle jauh lebih permeabel bagi anion
dibandingkan dengan kation, sehingga secara efektif yang
teramati hanya aliran anion dari luar masuk ke dalam
rongga micelle tanpa disertai aliran kation dari rongga
micelle ke luar. Hal ini dapat dilakukan dengan memiliki
material micelle yang tepat. Contonhnya material yang
menghasilkan permeabilitas anion sekitar 100 kali lebih
tinggi daripada kation. Anion yang mengalir masuk
bereaksi dengan kation yang ada dalam rongga micelle
membentuk partikel padatan yang ukurannya dibatasi oleh
ukuran micelle. Membran micelle juga menjadi pembatas
pertumbuhan ukuran partikel lebih lanjut dan menjadi
pelindung partikel dari aglomerasi.
Gambar 17 Difusi anion masuk ke dalam micelle.
Penyusunan Kristal Besar
Nanopartikel semikonduktor yang berukuran lebih
besar dapat disintesis dengan cara menambahkan molekul
lain kepada nanopartikel awal yang berukuran lebih kecil
dan distabilkan dengan ligand organik pada larutan koloid.
Sebagai contoh, telah ditemukan bahwa ukuran dari
kumpulan nanopartikel CdS yang dilapisi dengan ion-ion
thiophenolate dapat membesar jika logam sulfide
ditambahkan ke larutan tersebut.
Pembuatan polimer dari bahan inorganik diketahui
dapat diaplikasikan kepada sintesis kumpulan
nanopartikel semikonduktor yang cukup besar. Sebagai
contoh dari kumpulan nanopartikel pyramid
[Cd20S13(SC6H5)22]8-
mengandung 55 atom cadmium dan
sulfur, kumpulan nanopartikel pyramid
[Cd10S4(SC6H5)16]4-
mengandung 33 atom cadmium dan
sulfur. Jika ditambahkan ion sulfida lima kepada kedua
kumpulan nanopartikel tadi, maka kedua kumpulan
nanopartikel akan bergabung dan membentuk kumpulan
nanopartikel yang lebih besar. Hal ini dapat diilustarikan
pada Gbr. 18.](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-10-320.jpg)
![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 42
Gambar 18 Penggabungan 2 kumpulan nanopartikel
menjadi suatu kumpulan naopartikel yang lebih besar.
Struktur pyramid dari [Cd20S13(SC6H5)22]8-
telah
dikonfirmasi kebenarannya melalui analisis X-ray.
Penambahan terus ion sulfida dapat menghasilkan
kumpulan partikel tetrahedral Cd32S14(SC6H5)36 yang
mengandung 82 atom cadmium dan sulfur.
Kolloid Lain
Nanokristal Zn3P2 dan Cd3P2 dapat disintesis
dengan menginjeksikan phosphine (PH3) ke dalam larutan
yang mengandung garam logam. Pengontrolan ukuran
partikel dilakukan dengan menvariasi konsentrasi
phosphine dan suhu reaksi. Efek ukuran kuantum diamati
dengan jelas pada sample Zn3P2 dan Cd3P2 seperti
ditunjukan oleh warna material yang dihasilkan. Cd3P2
bulk berwarna hitam sedangkan larutan yang mengandung
nanokristal Cd3P2 (diamater sekitar 1,5 nm) tidak
berwarna.
Nanopartikel CdSe dapat disintesis dari larutan
yang mengandung dimethylcadmium (CH3)2Cd (di dalam
tri-n-occtylphosphine TOP) dan trin-octylphosphine
selenide (TOPSe) di dalam tri-n-octylphosphine oxide
(TOPO) panas pada rentang suhu antara 120–300 o
C.
Reaksi ini menghasilkan nanokrsital CdSe yang dicanteli
TOPO. Ukuran partikel dipengaruhi secara dominan oleh
suhu reaksi, di mana partikel yang lebih besar dihasilkan
pada suhu yang lebih tinggi.
Nanopartikel semikonduktor golongan III-V dapat
dibuat melaui reaksi padatan natrium pnictides dengan
halida golongan III pada suhu tinggi dan dalam wadah
tertutup. Nanopartikel GaP dan GaAs dapat dibuat dengan
menggunakan gallium (golongan III) halida dan (Na/K)3E
dengan E = P atau As. Metode ini lebih aman karena
mengghindari penggunaan material beracun seperti
phosphine atau arsine. Nanocrystal InAs dan InP dapat
disintesis melaui reaksi InX3 (X = Cl, Br, I) dengan
As(SiMe3)3 atau P(SiMe3)3.
Koloid semikonduktor InP dapat disintesis melalui
reaksi berikut ini pada suhu antara 150 o
C hingga 280 o
C
menurut persamaan
InCl3 + [(CH3)3Si]3P = InP + 3(CH3)3SiCl (3)
Amine atau tri-n-octylphosphine (TOP), atau tri-n-
octylphosphine oxide (TOPO) digunakan sebagai sebagai
stabilizer untuk menghindari penggumpalan InP. Ukuran
partikel berkisar antara 2,2 sampai 6 nm, bergantung pada
stabilizer yang digunakan. Lebar celah pita energi InP
ukuran bulk adalah 1.35 eV sedangkan nanokristal InP
menghasilkan nilai band gap antara 1.7 eV to 2.4 eV.
Nanokristal InAs juga dibuat dengan metode yang sama
dengan mereaksikan As[(CH3)3Si]3 dan InCl3.
Nanopartikel cobalt dapat dibuat dengan pirolisis
cepat dari prekursor organik Co(CO)8 di dalam atmosfer
argon dan dengan kehadiran surfaktan organik seperti
asam oleic dan asam trioctylphosphonic. Bentuk partikel
yang dihasilkan dapat berupa bola, kubus, atau bentuk
pentagon dengan ukuran antara 3 – 17 nm, bergantung
pada jenis stabuilizer yang digunakan.
Nanopartikel CdTe dapat dibuat dengan mereaksi
Na2Te dengan CdI2 dalam metanol pada suhu –78 o
C.
Diamater partikel yang dibuat berkisar antara 2,2 – 2,5
nm. Nanostructur CoxCu1-x dapat disintesis dengan
mereduksi larutan cobalt dan cupric chloride dalam air
dengan natrium borohydride. Natrium borohydride dapat
digunakan untuk mereduksi tembaga klorida di dalam
tetrahydrofuran (THF) untuk membuat nanopartikel Cu.
2.3 Metode Polyol
Proses polyol adalah cara lain menghasilkan
partikel logam seperti Cu, Ni, dan Co dalam ukuran
nanometer dalam medium bukan air. Dalam metode ini
precursor seperti logam oksida, logam nitrat, dan logam
asestat dilarutkan atau dicampur secara homogen dengan
ethylene glycol atau diethylene glycol kemudian direflux
pada suhu antara 180 - 194 o
C. Selama reaksi tersebut,
precursor direduksi membentuk partikel logam yang
kemudian mengendap di dalam larutan. Partikel CoxCu100-
x (4 ≤ x ≤ 49 at%) dapat disintesis dengan mereaksi cobalt
acetate tetrahydrate dan copper acetate hydrate di dalam
ethylene glycol. Campuran kemudian direflux pada suhu
180–190 o
C selama 2 jam. Partikel yang dihasilkan
mengendap di dalam larutan yang kemudian dikumpulkan
dan dikeringkan. Bubuk nanocrystalline Ni25Cu75 dapat
dibuat dengan mereduksi nikel dan tembaga asetat di
dalam ethylene glycol.
Berikut ini adalah contoh sintesis nanopartiel FePt
dengan metode polyol. Material yang digunakan adaalah
ethylene glycol, ferric acetyl acetonate atau Fe(acac)3, bis-
acetyl acetonate platinum atau Pt(acac)2, N,N-dimetyl
aminoethoxy ethanol atau (CH3)2N(CH2CH2O)3H dan
sodium hydroxyde atau NaOH. Sintesis diawali dengan
membuat prekursor Fe dengan cara melarutkan 369 mg
0,7 nm
+
1 nm
0,7 nm
+
1 nm](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-11-320.jpg)


![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 45
tersebut belum mengubah secara signifikan tegangan
permukaan maupun viskositas larutan. Makin kecil
konsentrasi larutan maka makin sedikit jumlah zat terlarut
dalam droplet yang menyebabkan makin kecil ukuran
partikel yang dihasilkan; (b) Partikel yang dihasilkan
sangat bulat. Bentuk droplet yang dihasilkan spray selalu
bulat, karena bentuk ini memiliki energi paling kecil.
Dengan asumsi bahwa atom-atom pelarut menguap secara
homogen di semua bagian permukaan droplet maka
selama proses mengecilnya ukuran droplet akibat
penguapan pelarut, bentuk droplet tetap bulat. Pada
akhirnya, bentuk akhir partikel yang dihasilkan pun bulat;
(c) Jika konsentrasi droplet tidak terlalu tinggi maka
setelah terbentuknya partikel, konsentrasi partikel di
dalam aliran gas juga tidak tinggi. Peluang terjadinya
tumbukan yang membuat partikel menyatu sangat kecil.
Akibatnya tidak terjadi aglomerasi pada partikel yang
dihasilkan.
Kristalitas partikel yang dihasilkan dapat dikontro
dengan dua cara: (a) Mengontrol suhu reaktor. Makin
tinggi suhu reaktor maka makin tinggi kristalinitas
partikel yang dihasilkan; (b) Mengontrol laju aliran
carrier gas. Laju aliran cariier gas menentukan berapa
lama partikel berada di dalam reaktor. Makin kecil laju
aliran gas maka makin lama partikel berada di dalam
reaktor. Secara kasar berlaku.
[Waktu dalam reaktor] ∝1/[laju aliran gas] (5)
Makin lama partikel berada dalam reaktor maka makin
lama proses pemanasan yang dialami partikel. Akibatnya
makin baik kristalinitas partikel. Gambar 22 adalah
contoh partikel Y2O3-ZrO2 yang dibuat dengan metode
spray pirolisis. Ukuran rata-rata partikel sekitar ratusan
mm.
Gambar 22 Contoh partikel Y2O3-ZrO2 yang dibuat
dengan metode spray pirolisis.
Contoh lain adalah sintesis nanopartikel TiO2.
Pada sintesis ini digunakan titanium-tetra-isopropoxide
(TTIP) digunakan sebagai pemulai reaksi dan helium
sebagai carrier gas pembawa. Laju aliran gas oksigen
diatur, namun tekanan dan suhu pada tabung reaksi dijaga
tetap 10 mbar dan 1000 o
C. Bubuk titania yang berbentuk
kristal diukur besarnya dengan menggunakan metoda
Scherrer dengan menggunakan difraktometer sinar-X dari
partikel yang dikumpulkan pada batang quartz yang tipis
yang diletakkan pada pusat tabung reaksi secara
horizontal. Pada percobaan ini sendiri, ukuran partikelnya
belum diketahui berapa besarnya.
Filter expansion spray pyrolisis.
Ukuran partikel yang dihasilkan dengan metode
spray pirolisis sangat bergantung pada ukuran droplet.
Ukuran droplet yang dihasilkan dengan berbagai macam
spray biasanya beberapa mikrometer hingga puluhan
mikrometer. Dengan ukuran tersebut biasanya ukuran
partikel yang dihasilkan minimal berorde submikrometer.
Sangat sulir mensintesis partikel dengan ukuran kurang
dari 100 nm dengan metode spray pirolisis.
Agar kita dapat menghasilkan partikel yang lebih kecil
maka ukuran partikel harus dapat direduksi lebih lanjut.
Salah satu metode membuat droplet dengan ukuran lebih
kecil adalah menggunakan gelas berpori yang
dihubungkan dengan tekanan rendah. Metode ini disebut
filter expansion spray pyrolisis.
Droplet yang dihasilkan dari spray diarahkan ke
filter gelas yang mengandung pori-pori yang berukuran
kecil. Di permukaan atas filter gelas terbentuk lapisan
tipis zat cair. Tekanan rendah di bawah menyebabakan
lapisan zat cair turun melalui pori-pori gelas dan keluar di
sisi bawah gelas dengan ukuran yang sangat kecil.
Partikel yang baru saja keluar ditarik ke arah filter meluai
sebuah tabung reaktor bersuhu tinggi yang dihubungan
dengan filter penyaring partikel. Suhu reaktor diatur
sehingga begitu sampai filter kolektor, droplet sudah
berubah menjadi partikel akhir.
5nm
D = 8.9 nm
20nm
(a) 700 o
C
5nm
D = 8.9 nm
20nm
(a) 700 o
C](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-14-320.jpg)

![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 47
Gambar 25 Gambar kiri adalah foto SEM partikel yang
dihasilkan dari reaktor spray. Ukuran partikel lebih dari 1
mm. Gambar kanan adalah foto TEM partikel setelah
partikel pada gambar kiri dicuci dan disentrifuge beberapa
kali.
Pembuatan Partikel Berporos dengan Spray Pyrolisis.
Di samping digunakan untuk membuat partikel
padatan, metode spray pirolisis juga dapat digunakan
untuk membuat partikel berporos. Caranya adalah
menambahkan koloid polimer ke dalam prekursor yang
akan dispray. Akibatnya, droplet yang dihasilkan
disamping mengandung prekursor juga mengandung
partikel-partikel polimer. Tabung reaktor minimal harus
dibagi atas dua daerah pemanasan. Daerah pemanasan
pertama diset pada suhu yang tidak terlalu tinggi, sekedar
untuk menguapkan pelarut sehingga didapatikan prekuros
dalam bentuk padat yang di dalamnya terdapat partikel-
partikel polimer. Daerah pemanasan kedua dimaksudkan
untuk melakukan reaksi pirolisis dan mendekomposisi
polimer. Setelah polimer terdekomposisi, lokasi yang
semula ditempati polimer menjadi poros. Gambar 26
adalah ilustrasi proses pembentukan partikel berporos.
Gambar 27 adalah contoh partikel berporos yang
dihasilkan dengan metode ini.
Porositas partikel yang dihasilkan (fraksi volum
poros) dikontrol dengan mengatur perbandingan
konsentrasi partikel polimer terhadap konsentrasi
prekursor. Makin tinggi konsentrasi polimer maka makin
tinggi porositas partikel yang dihasilkan. Ukuran poros
dikontrol dengang menggunakan partikel polimer yang
berukuran berbeda-beda.
Gambar 26 Ilustrasi proses pembentukan partikel
berporos
Carbon Nanotube
Di sini kita akan membahas salah satu metode
sederhana membuat carbon nanotube, yaitu dengan
metode spray pirolisis. Dengan metode spray pirolisis,
carbon nanotubes dapat dibuat pada suhu relative rendah,
sekitar 800 o
C. Proses sintesis mencakup spray ferrocene
[Fe(C5H5)2] dan benzene (C6H6) dalam reactor spray
melalui sebuah tabung gelas quartz menggunakan argon
sebagai gas pembawa. Ferrocene berperan sebagai katalist
yang memungkinkan penyusunan molekul-molekul
Partikel yang keluar
dari reaktor
Dicuci/sentrifuge
beberapa kali
Nanopartikel
Partikel yang keluar
dari reaktor
Dicuci/sentrifuge
beberapa kali
Nanopartikel
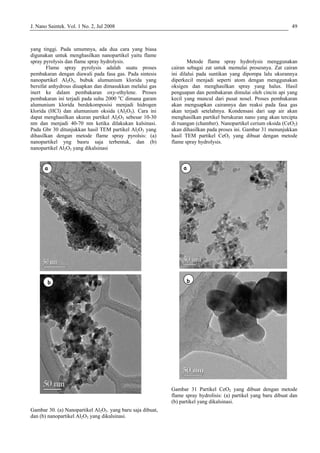
Exhaust
Nebulizer
utrasonic
Furnace
Heater
Reaksi pada
suhu tinggi
Pengeringan
pada suhu rendah
spray
Prekursor
dan koloid
Gas
pembawa
Exhaust
Nebulizer
utrasonic
Furnace
Heater
Reaksi pada
suhu tinggi
Pengeringan
pada suhu rendah
spray
Prekursor
dan koloid
Gas
pembawa](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-16-320.jpg)






![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 56
Gambar 41 Proses pembuatan cangkang dan partikel
logam yang teroganisasi.
Gambar 42 (a) cangkang dan (b) partikel logam yang
teroganisasi yang dibuat dengan metode koloidal
templating dan over sputtering.
Referensi
[1] W. Budiawan, A. S. Vioktalamo, M. Abdullah, dan
Khairurrijal, J. Sains Materi Indonesia (Edisi Khusus),
180 (2006).
[2] W. Budiawan, A. S. Vioktalamo, M. Abdullah, dan
Khairurrijal, Pertemuan Ilmiah Iptek Bahan 2006
(Serpong, 18-19 Juli 2006).
[3] W. Budiawan, M. Abdullah, and Khairurrijal, Proc.
Int. Conf. Mathematics and Natural Sciences
(Bandung 29-30 November 2006) pp. 1069-1072.
[4] L. Gradon, S. Janeczko, M. Abdullah, F. Iskandar,
and K. Okuyama, AIChE J. 50, 2583 (2004).
[5] F. Iskandar, M. Abdullah, H. Yoden, and K.
Okuyama, J. Appl. Phys. 93, 9237 (2003).
[6] F. Iskandar, M. Abdullah, H. Yoden, and K.
Okuyama, Virt. J. Nanoscale Sci. & Technol. 7, no.
22, June 2 (2003).
[7] F. Iskandar, M. Abdullah, H. Yoden, and K.
Okuyama, J.Sol-Gel Sci. Technol. 29, 41 (2004).
[8] F. Iskandar, M. Abdullah, and K. Okuyama, in
Encyclopedia of Nanoscience and Nanotechnology
(HS.Nalwa, Ed.); American Scientific Publishers,
vol.8, 259 (2004).
[9] F. Iskandar, Mikrajuddin, and K. Okuyama, Nano
Lett. 1, 231 (2001).
[10]F. Iskandar, Mikrajuddin, and K. Okuyama, Nano
Lett. 2, 389 (2002).
[11]Y. Itoh, M. Abdullah, and K. Okuyama, J. Mater. Res.
19, 1077 (2004).
[12]Y. Itoh, T. Ogi, M. Abdullah, F. Iskandar, K.
Okuyama, and Y. Azuma, J. Cryst. Growth 281, 234
(2005).
[13]T. Iwaki, Y. Kakihara, T. Toda, M. Abdullah, and K.
Okuyama, J. Appl. Phys. 94, 6807 (2003).
[14]M. Abdullah and Khairurrijal, Proc. 3rd Kentingan
Physics Forum (Solo, 24 September 2005), pp. 69-70.
[15]M. Abdullah and K. Okuyama, Proc. ITB Eng. Sci.
35B, 81 (2003).
[16]M. Abdullah and K. Okuyama, Proc. ITB Eng. Sci.
36B,140 (2004).
[17]M. Abdullah dan F. Iskandar, Pros. Seminar MIPA
IV-ITB 2004, Bandung, Indonesia, 6-7 Oktober 2004,
pp. 243-247.
[18]M. Abdullah, C. Panatarani, T.-O. Kim and K.
Okuyama, J. Alloys Comp. 377, 298 (2004).
[19]M. Abdullah, F. Iskandar, S. Shibamoto, T. Ogi and
K. Okuyama, Acta Materialia 52, 5151 (2004).
[20]M. Abdullah, F. Iskandar, and K. Okuyama, Proc.
ITB Eng. Sci. 36B, 125 (2004).
[21]M. Abdullah, I. W. Lenggoro, B. Xia, and K.
Okuyama, J. Ceram. Soc. Jpn. 113, 97 (2005).
[22]M. Abdullah, I. W. Lenggoro, F. G. Shi, and K.
Okuyama, Proceeding 47th Meeting of Japan
Academic of Science, Kyoto University, Japan, 29 -
30 October 2003, pp. 199-200).
[23]M. Abdullah, I. W. Lenggoro, K. Okuyama, and F. G.
Shi, J. Phys. Chem. B 107, 1957 (2003).
[24]M. Abdullah, I. W. Lenggoro, K. Okuyama, and S.
Taya, J. Non-Crystalline Sol. 351, 697 (2005).
[25]M. Abdullah, I. W. Lenggoro, and K. Okuyama, in
Encyclopedia of Nanoscience and Nanotechnology
(HS.Nalwa, Ed.); American Scientific Publishers,
(b) Pemansan suhu tinggi
Partikel yang terorganisasi
Cangkang mrlrlah
dan jatuh
(b) Pemansan suhu tinggi
Partikel yang terorganisasi
Cangkang mrlrlah
dan jatuh
300 nm
a
b
2 µm
300 nm
a
b
2 µm](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-25-320.jpg)
![J. Nano Saintek. Vol. 1 No. 2, Jul 2008 57
vol.8, 731 (2004).
[26]M. Abdullah, ITSF Seminar on Science and
Technology Jakarta, February 7, 2007
[27]M. Abdullah, Khairurrijal, A. Waris, W. Sutrisno, I.
Nurhasanah, and A. S. Vioktalamo, Powder Technol.
183, 297 (2008).
[28]M. Abdullah, Khairurrijal, F. Iskandar and K.
Okuyama, in Nanocrystalline Materials: Their
Synthesis-Structure-Property Relationships and
Applications (S.C. Tjong Ed.), Elsevier, 275 (2006).
[29]M. Abdullah, Media Fisika 2, 39 (2003).
[30]M. Abdullah, Prosiding Simposium Mahasiswa
Fisika Nasional ITS-Surabaya (2005).
[31]M. Abdullah, REAKTOR 7, 47 (2003).
[32]M. Abdullah, S. Shibamoto, and K. Okuyama, Opt.
Mater. 26, 95 (2004).
[33]M. Abdullah, T. Morimoto, and K. Okuyama, Adv.
Func. Mater. 13, 800 (2003).
[34]Mikrajuddin, F. Iskandar, K. Okuyama, and F.G. Shi,
J. Appl. Phys. 89, 6431 (2001).
[35]Mikrajuddin, F. Iskandar, and K. Okuyama, Adv.
Mater. 14, 930 (2002).
[36]Mikrajuddin, F. Iskandar, and K. Okuyama, Int.
Symp. Nanoparticles: Aerosols and Materials, Pusan,
Korea, July 5-6 (2001).
[37]Mikrajuddin, F.G. Shi, and K. Okuyama, J.
Electrochem. Soc. 147, 3157 (2000).
[38]Mikrajuddin, Ferry Iskandar, and Khairuddin,
INTEGRAL 8, 19 (2003).
[39]Mikrajuddin, Ferry Iskandar, and Kikou Okuyama,
2nd Kentingan Physics Forum, UNS, Surakarta, July
28 (2003).
[40]Mikrajuddin, I. W. Lenggoro, K. Okuyama, and F.G.
Shi, J. Electrochem. Soc. 149, H107 (2002).
[41]Mikrajuddin, J. Matematika & Sains 8, 1 (2003).
[42]Mikrajuddin, Proc. ITB Sains & Teknologi 35A, 71
(2003).
[43]L. Marlina, M. Abdullah, Khairurrijal, W. Budiawan,
and I. Sriyanti, 2007 Conference on Solid State Ionics
(Serpong, 1-3 August 2007).
[44]L. Marlina, M. Abdullah, dan Khairurrijal, The 3rd
National Seminar on Chemistry and Chemical
Education, Bandung April 11, 2007
[45]I. Nurhasanah, Khairurrijal, M. Abdullah, M.
Budiman, and Sukirno, Int. Conf. Mathematics and
Natural Sciences (Bandung 29-30 November 2006)
pp. 988-990
[46]I. Nurhasanah, Khairurrijal, M. Abdullah, M.
Budiman, and Sukirno, 2007 Conference on Solid
State Ionics (Serpong, 1-3 August 2007).
[47]I. Nurhasanah, M. Abdullah, and Khairurrijal, Int.
Conf. Neutron and X-Ray Scattering (Bandung, 29-
31 July 2007).
[48]K. Okuyama, I. W. Lenggoro, and M. Abdullah, 2004
International Conference for Particle Technology
(Partech2004), Nuremberg, Germany, March 17
(2004).
[49]K. Okuyama, I. W. Lenggoro, and M. Abdullah, 2nd
Asian Particle Technology Symposium, Penang,
Malaysia, December 17-19 (2003).
[50]Okuyama, K., M. Abdullah, F. Iskandar, and I. W.
Lenggoro, Adv. Powder Technol. 17, 587 (2006)
[51]I. Sriyanti, M. Abdullah, Khairurrijal, and L. Marlina,
2007 Conference on Solid State Ionics (Serpong, 1-3
August 2007).
[52]I. Sriyanti, M. Abdullah, dan Khairurrijal, 3rd
National Seminar on Chemistry and Chemical
Education, Bandung April 11, 2007
[53]A.S. Vioktalamo, M. Abdullah, W. Budiawan, and
Khairurrijal, 1st Int.l Conf. Advanced Materials and
Practical Nanotechnology Serpong-Banten (2006).
[54]A.S. Vioktalamo, M. Abdullah, dan S.Z. Bisri, Pros.
Seminar Nasional Kimia Fisik dan Anorganik (2006).
[55]M. Abdullah, Khairurrijal, A. R. Marully, Liherlinah,
dan M. Sanny, J. Nano Saintek. 1, 1 (2008).
[56]M. Abdullah dan Khairurrijal, J. Nano Saintek. 1, 12
(2008).
[57]Liherlinah, M. Sanny, A. R. Marully, M. Abdullah
dan Khairurrijal, J. Nano Saintek. 1, 23 (2008).
[58]M. Abdullah, Khairurrijal, I. Nurhasanah, I. Sriyanti,
dan A. R. Marully, J. Nano Saintek. In press
View publication statsView publication stats](https://image.slidesharecdn.com/review-sintesisnanomaterial-180912003658/85/Review-sintesis-nanomaterial-26-320.jpg)